期末测试
一、选择题(共20分,每小题2分。每小题只有1个正确答案,请将正确答案的序号填入题后括号内)
1.下列说法中错误的是( )
A.干冰不是冰 B.纯碱不是碱
C.食盐不是盐 D.铅笔芯不含铅
2.草木灰是农家肥,其主要成分是( )
A.氮肥 B.磷肥
C.钾肥 D.复合肥
3.下列各组物质中,一定都含有氧元素的是( )
A.碱、金属氧化物 B.盐、非金属氧化物
C.盐、金属氧化物 D.酸、非金属氧化物
4.下列叙述中正确的是( )
A.生铁只含铁元素
B.生铁柔软、钢易碎
C.不锈钢不含铁元素
D.钛合金具有很好的抗腐蚀性能
5.某些食物的近似pH为,牛奶 6.3~6.6,葡萄 3.5~4.5,玉米粥 6.8~8.0,苹果 2.9~3.3,其中酸性最强的是( )
A.葡萄 B.牛奶
C.玉米粥 D.苹果
6.将100 g 20%的食盐溶液稀释成10%的溶液,需加水的质量为
A.80 g B.100 g
C.200 g D.180 g
7.R及其化合物所发生的下列反应,属于复分解反应的是( )
A.R+Hg(NO3)2===Hg+R(NO3)2
B.RO+CO![]() R+CO2
R+CO2
C.R(OH)2+2HCl===RCl2+2H2O
D.R(OH)2![]() RO+H2O
RO+H2O
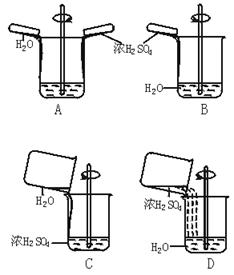
8.下列稀释浓硫酸的操作正确的是( )
9.下列有关营养素的说法,不正确的是( )
A.营养素包括蛋白质、糖类、油脂、维生素、无机盐和水六大类
B.蛋白质是构成细胞的基本物质
C.糖类是维持生命活动的备用能源
D.酶是一种重要的蛋白质
10.要增大硝酸钾稀溶液中溶质的质量分数,不能采用的方法是( )
A.加硝酸钾溶液 B.降低溶液温度
C.加入硝酸钾晶体 D.加热蒸发溶剂
二、选择题(共30分,每小题3分。每小题有1个或2个正确答案,请将正确答案的序号填入题后括号内)
11.下面是硝酸钾和氯化钠的溶解度曲线。下列说法中,不正确的是( )
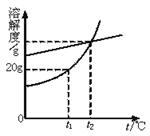
A.硝酸钾的溶解度受温度的影响比氯化钠大
B.t1℃时,100 g硝酸钾饱和溶液中含有20 g 硝酸钾
C.t2℃时,氯化钠饱和溶液与硝酸钾饱和溶液中溶质的质量分数相同
D.温度高于t2℃时,硝酸钾的溶解度大于氯化钠的溶解度
12.通过下列类型的反应:①化合反应 ②分解反应 ③置换反应 ④复分解反应,能产生CO2的是( )
A.①④ B.①②④
C.①②③ D.全部
13.把一定量的锌粉加入到硝酸根和硝酸铜的混合溶液中,充分反应后过滤,滤纸上的残留物可能是( )
A.Zn和Cu B.Zn和Ag
C.Cu和Ag D.Ag
14.下列制取物质所选用的试剂正确的是( )
A.用石灰石与稀硫酸制取二氧化碳
B.用碳酸钠溶液与石灰水制取氢氧化钠
C.用锌与稀硝酸制取氢气
D.用铁跟盐酸反应制取氯化铁
15.某物质R是人类生命活动中不可缺少的物质。已知R的相对分子质量为150,其中含碳元素40%,含氢元素6.7%,其余为氧元素。则R的化学式为( )
A.C5H10O2 B.C5H10O5
C.C6H6O6 D.C6H12O6
16.下列转化通过一步反应不能实现的是( )
A.Ba(OH)2→NaOH B.Cu→Cu(OH)2
C.Fe2O3→Fe(OH)3 D.MgCO3→MgCl2
17.在pH=1的无色溶液中,不能大量共存的离子是( )
A.Al3+、Ag+、NO![]() 、Cl- B.Mg2+、NH
、Cl- B.Mg2+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
C.Ba2+、Na+、SO![]() 、NO
、NO![]() D.Zn2+、K+、SO
D.Zn2+、K+、SO![]() 、NO
、NO![]()
18.下列实验结论错误的是( )
A.某无色溶液滴加酚酞试液显红色,该溶液不一定是碱溶液
B.某固体加入稀硫酸,产生了无色气体,证明该固体一定是活泼金属
C.某溶液滴加氯化钡溶液后,生成不溶于稀硝酸的白色沉淀,证明该溶液中可能有Ag+
D.将适量氯化钙溶液加入到在空气中部分变质的烧碱溶液中,可得到纯净的烧碱溶液
19.下列各组物质,只用无色酚酞试液及相互反应就能区别开来的是( )
A.NaOH、HCl、H2SO4
B.NaOH、HCl、NaCl
C.Na2CO3、HCl、NaCl
D.NaOH、Ca(OH)2、Ba(OH)2
20.用Zn、CuO、稀H2SO4作原料制取Cu,有两种途径:
①Zn![]() H2
H2![]() Cu
Cu
②CuO![]() CuSO4
CuSO4![]() Cu
Cu
若用这两种方法制得的铜的质量相等,下列叙述符合实验结果的是( )
A.消耗相同质量的氧化铜 B.消耗相同质量的锌
C.消耗相同质量的稀硫酸 D.生成硫酸锌的质量相同
三、填空和简答题(共28分)
21.(2分)最简单的有机物是_____________,组成物质种类最多的元素是_____________。
22.(2分)下表是某地市场上销售的一种“加碘盐”包装袋上的部分文字说明。请根据此表,结合初中学过的化学知识,回答下列问题:
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20~40 mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
(1)碘酸钾属于哪类化合物?
___________________________(填酸、碱、盐或氧化物)
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时_____________。
23.(4分)欲除去下列物质中含有的少量杂质,将除去杂质加入的试剂和方法的标号填入相应的答案栏里。(每个答案栏里只填1个标号,每个标号只能填写1次)
| 物质 | 杂质 | 答案 | 加入试剂、方法 |
| 氯化锌 | 氯化铜 | a.加入适量盐酸,过滤 b.加入适量氢氧化钠溶液,过滤 c.加入适量碳酸钠溶液,过滤 d.加入适量盐酸e.加入适量锌粉,过滤 | |
| 氯化钠 | 碳酸钠 | ||
| 炭粉 | 氧化铜 | ||
| 氢氧化钠 | 氢氧化钙 |
24.(4分)请写出四种鉴别稀硫酸与氢氧化钠溶液的方法。
(1)___________________________________
(2)___________________________________
(3)___________________________________
(4)___________________________________
25.(4分)初中化学学习过程中,我们可以总结或发现许多具有一定规律性的知识,例如:
①实验室制取气体装置都要检查气密性
②金属与酸发生置换反应后,溶液的质量都增加
你还能总结出哪些规律?试写出两条(不要重复课本已总结出的规律):
(1)___________________________________
(2)___________________________________
26.(6分)某化学制剂厂甲、乙、丙、丁四个车间排放的废水中,主要成分分别含有CuCl2、HCl、Na2CO3、NaOH中的一种。从环保角度考虑,该厂决定综合处理废水:通过调节废水流量,使乙、丁两车间废水相对过量,最终排出的溶液呈中性。处理过程如下图所示。请回答:
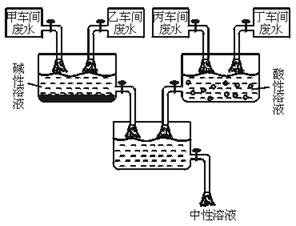
(1)甲、丙、丁三车间排放的废水中,主要成分是:甲车间:_______________,丙车间:_____________,丁车间_____________。
(2)用_____________来检测最终排出的溶液已呈中性。
(3)请具体说明在处理过程中,乙车间和丁车间排出的废水相对过量的目的是:___________________________________
27.(6分)单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示:
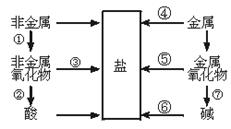
限选择铁、碳、氧气、盐酸、氧化钙、氢氧化钙、二氧化碳、水八种物质作为反应物,将上图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)
例①C+O2![]() CO2
CO2
②___________________________________
③___________________________________
④___________________________________
⑤___________________________________
⑥___________________________________
⑦___________________________________
四、实验题(12分)
28.为了验证某混合气体由H2、CO和HCl组成,请从下图中选择适当的实验装置设计一个实验,并回答下列问题。(假设每步反应均完全)

(1)装置连接的顺序是___________________________。(用字母表示)
(2)你所选择的第一个装置的作用___________________________;
(3)写出你所选最后一个装置中发生反应的化学方程式:_________________________
(4)A装置在实验过程中玻璃管内的现象是___________________________;
(5)若省略你所选择的第二个装置,则不能验证出的气体是______________________。
(6)简述该实验尾气的处理方法___________________________。
五、计算题(共10分,每小题5分)
29.某化肥厂生产一批尿素产品,经测定,其含氮元素的质量分数为42%(杂质不含氮)。按规定,产品中含尿素〔CO(NH2)2〕的质量分数在95%以上为一级品,试根据计算判断该厂所生产的产品是否属于一级品。
30.55.7 g碳酸钠溶液恰好与36.5 g某盐酸溶液完全反应,测得反应后溶液的质量为90 g,求:
(1)生成了多少克二氧化碳?
(2)反应后所得溶液的溶质质量分数是多少?
参考答案
一、1.C 2.C 3.A 4.D 5.D 6.B 7.C 8.B 9.C 10.B
二、11.B 12.D 13.CD 14.B 15.B 16.BC 17.AC 18.BD 19.BC 20.A
三、21.甲烷 碳
22.(1)盐 (2)易分解
23.e d a c
24.(1)用酚酞试液鉴别
(2)用石蕊试液鉴别
(3)用BaCl2鉴别
(4)用CuSO4鉴别
25.(1)实验室制取气体时,不溶于水且不与水反应的气体都可以用排水法收集。
(2)单质铁参加的置换反应,反应后铁一般表现为+2价。
26.(1)CuCl2 Na2CO3 HCl
(2)pH试纸(或其他合理的方法)
(3)为了分别除尽废水中的CuCl2或Na2CO3(或Cu2+或CO![]() )
)
27.②CO2+H2O===H2CO3
③CO2+Ca(OH)2===CaCO3↓+H2O
④Fe+2HCl===FeCl2+H2↑
⑤CaO+2HCl===CaCl2+H2O
⑥Ca(OH)2+2HCl===CaCl2+2H2O
⑦CaO+H2O===Ca(OH)2
四、28.(1)CDAEB
(2)证明HCl气体的存在
(3)CO2+Ca(OH)2===CaCO3↓+H2O
(4)黑色粉末变为光亮的红色
(5)氢气
(6)使其燃烧
五、29.解:(1)设此化肥厂生产的化肥中含尿素的质量分数为x
CO(NH2)2 ~ 2N (1分)
60 28
x 42% (1分)
![]() (1分)
(1分)
x=![]() =90%
(1分)
=90%
(1分)
因90%<95%,所以该厂生产的化肥不属于一级品。 (1分)
答:(略)
30.解:(1)生成二氧化碳的质量为:
(55.7 g+36.5 g)-90 g=2.2 g (1分)
设完全反应后生成氯化钠的质量为x
Na2CO3+2HCl===2NaCl+H2O+CO2↑ (1分)
117 44
x 2.2 g
![]() (1分)
(1分)
x=![]() =5.85 g
(1分)
=5.85 g
(1分)
![]() ×100%=6.5%
(1分)
×100%=6.5%
(1分)
答:(略)