化学式复习题(2)
班级 姓名 成绩
一、选择题(下列各题只有一个选项符合题意)
1.下列关于分子的叙述,正确的是 ( )
A.一切物质都是由分子构成的。 B.分子是化学变化中的最小微粒。
C.分子是不能再分的微粒。 D.分子是保持物质化学性质的一种微粒。
2.表示4个氢原子的符号是 ( )
A.2H2 B.4H2 C.4H D.4H+
3.下列物质的化学式与名称一致的是 ( )
A.氧化镁MgO2 B.二氧化硫O2S C.氯气Cl2 D.锰酸钾KMnO4
4.“H2O”表示一个水分子由 ( )
A.氢氧两种分子组成 B.二个氢元素的一个氧元素组成
C.二个氢原子和一个氧原子构成 D.一个氢分子和一个氧原子组成
5.下列物质属于纯净物的是 ( )
A.胆矾与无水硫酸铜混合 B.氧气与臭氧(O3)混合
C.高锰酸钾与锰酸钾混合 D.冰与水的混合
6.水是纯净物的特征是 ( )
A.由氢、氧两种元素组成 B.能溶解许多物质
C.有固定的组成和性质 D.通电分解后生成氢气和氧气
7.下列物质中为地壳中含量最多的金属的氧化物的化学式是 ( )
A.SiO2 B.CaO C.Al2O3 的32倍D.Fe3O4
8.构成氧气的分子和构成液氧的分子具有 ( )
A.相同的性质 B.不同的性质 C.相同的化学性质 D.不同的化学性质
9.硫元素的相对原子质量为32,表示的意义是 ( )
A.表示硫元素的相对原子质量为32g
B.表示一个硫原子的质量为32g
C.表示硫原子核中有32个质子
D.表示一个硫原子的质量是一个碳原子(C-12)质量的1/12的32倍
10.单质和化合物的区别在于是否由 ( )
A.同种物质的成 B.同种元素组成 C.同种分子组成 D.同种微粒组成
11.钾的相对原子质量较氩的相对原子质量小1,而核电荷数大1,由此可推断,一个钾原子和一个氩原子所含中子数的的关系是 ( )
A.钾的中子数比氩的中子数少1个 B.钾的中子数比氩中子数少2个
C.钾的中子数等于氩的中子数 D.钾的中子数比氩的中子数多1个
12.甲原子与乙原子的质量为2∶3,而乙原子与一种碳原子质量比为5∶4,则甲的相对原子质量为( )
A.10 B.5/24 C.432 D.4/45
13.有两种微粒所含质子数相等,下列说法正确的是 ( )
A.属同种元素 B.属不同种元素 C.是同种原子 D.上述说法都不全面
14.1.6g某物质完全燃烧后,生成4.4g二氧化碳和3.6g水,该物质的组成中一定含有的元素是 ( )
A.只含有碳元素 B.碳、氧两种元素 C.碳、氢两种元素 D.碳、氢、氧三种元素
15.下列物质中含氮质量分数最高的是 ( )
A.尿素[CO(NH2)2] B.磷酸二氢铵[NH4H2PO4]
C.氨气[NH3] D.硫酸铵[(NH4)2SO4]
16.有四种物质,它们的化学式分别为:a.AgNO3 b.Fe2(SO4)3 c.BaSO4 d.Fe(NO3)3。它们的式量由大到小排列顺序为 ( )
A.a>b>c>d B.b>c>a>d C.b>d>c>a D.a>c>d>b
l7.相同数目的氧气分子和氢气分子的质量比是 ( )
A.16:1 B.1:16 C.32:1 D.1:32
18.书写化学式时,元素符号右下角的数字表示的意义是 ( )
A.表示这种分子的个数 B.表示这种物质一个分子里所含该元素的原子个数
C.表示这种物质一定是化合物 D.表示这种物质中所含元素的种类数目
19.质量相等的二氧化硫和三氧化硫中,氧元素的质量比是 ( )
A.2:3 B.1:1 C.5:6 D.7:2
20.下列各组物质中,前者是混合物而后者是单质的是 ( )
A.含氮为35%的硝铵[NH4NO3],硫粉 B.洁净的空气、水银
C.食盐水,水 D.碱式碳酸铜,金属铝
二、选择题(以下各题有1—2个选项符合题意)
21.原子是 ( )
A.不可分割的实心球 B.可以构成分子,也可以直接构成物质
C.由原子核和电子构成 D.最小的微粒
22.下列各组元素,元素符号的大写字母相同的组是 ( )
A.钡、溴、镁 B.氯、钙、钾 C.铝、银、氩 D.氮、钠、氖
23.1985年科学家发现一种组成为C60的物质,下列说法正确的是 ( )
A.它的1个分子中含有60个原子 B.它是一种新型化合物
C.它是一种单质 D.化学式量为60
24.由氧化镁和另一种金属氧化物组成的混合物4g,经测定知其中含氧元素1.8g,则另一种金属氧化物是 ( )
A.CaO B.Fe2O3 C.Al2O3 D.CuO
25.1t氮肥的市场价格如下:CO(NH2)21080元;(NH4)2SO4450元;NH4NO3810元;NH4HCO3330元,分别用相同金额采购上述氮肥,购得氮肥含氮元素最多的是: ( )
A.CO(NH2)2 B.(NH4)2SO4 C.NH4NO3 D.NH4HCO3
26.双氧水的化学式为H2O2,它在一定条件下发生的反应可以用文字表达为:双氧水→水+氧气,下列有关双氧水的说法正确的是: ( )
A.双氧水的分子由一个氢分子和1个氧分子构成。
B.每个双氧水分子是由一个水分子和一个氧原子构成。
C.每个双氧水分子中含有二个氢原子和二个氧原子。
D.此反应为分解反应。
27.某氧化物中,碳元素与氧元素的质量比为3∶4,对此氧化物中各关系的叙述正确的是:( )
A.碳与氧的原子个比是1∶1 B.碳元素的质量分数为27.27%
C.碳与氧的原子个数比为1∶2 D.氧元素的质量分数为57.14%
28.测知一氧化碳跟某气体X的混合物中氧元素的质量分数为55%,则气体X的化学式是 ( )
A.CO2 B.NO2 C.SO2 D.SO3
29.某物质经化验是含一种元素,则该物质 ( )
A.一种单质 B.一种化合物 C.化合物与单质的混合物
D.既可能是一种单质,也可能是几种单质的混合物
30.加热等质量的氯酸钾,高锰酸钾和氧化汞,得到氧气的质量是 ( )
A.氯酸钾最多 B.高锰酸钾最多 C.一样多 D.氧化汞最少
三、填空题
31下列物质:①氮气②铜丝③二氧化锰④液氧⑤空气⑥白磷⑦碱式碳酸铜加热完全反应后的固体物质⑧实验室用氯酸钾、二氧化锰制取氧气后的固体物质⑨水银。九种物质中用序号填写符合下列要求的物质
(1)属于混合物的是_______(2)属于纯净物的是_______
(3)属于化合物的是_______(4)属于单质的是________
(5)属于氧化物的是_______(6)属于金属单质是________
32.完成下列各项空白
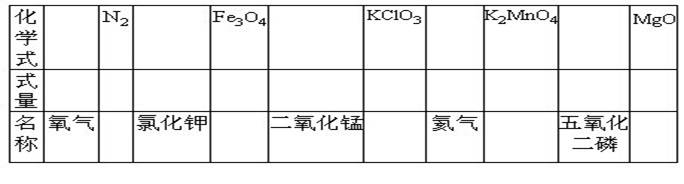
33.在化学的发展方面起了重大作用的近代化学家有①阿佛加德罗,②汤姆生,③道尔顿,④拉瓦锡。用序数填空:
研究空气成分,得出空气是由氧气和氮气组成结论的科学家是_______,发现电子的科学家是________,提出分子概念,指出原子和分子的区别与联系理论的科学家是________,提出近代原子学说的科学家是________。
34.将下列符号中“2”所表示的意义填写在栏线上
(1)H2O____________________________________
(2)2Cu_____________________________________
(3)2H2_____________________________________
(4)2SO3___________________________________
(5)2H______________________________________
35.在括号里填上物质的名称,在名称下的横线上填写物质的化学式
(1)锌+( ) → 氧化锌 (2)( )→ 汞+ 氧气
______+ _______ →________ _______ →________+________
(3)( )+氧气→ 二氧化碳 (4)( )→ 氯化钾+氧气
_______+_______→_______ _________→________+________
四、简答题
36.应用分子的观点解释下列现象
(1)氧气的密度比空气大,但纯净的氧气不能长期保存在敞口容器中。
(2)为什么人们常把湿衣服晾在太阳晒着的地方易干?
37.把桔红色的氧化汞固体放在试管中加热,可以看到试管壁上有银白色的小液滴生成,用带火星的木条在试管口检验,发现木条复燃。
(1)从原子、分子的观点看,上述分解反应的实质是________________________
(2)从上述反应的分析可以说明原子与分子的区别是____________________________________,原子的定义是_________________________________________________________
38.1g氧原子和1g铁原子里,哪个所含的原子个数多?为什么?
五、推断题
39.分子由四种元素共10个原子构成的绿色粉末状固体,受热后完全分解生成水,氧化铜和二氧化碳,试推断这种绿色固体是什么物质。
(1)名称____________________________,化学式_______________________________
(2)用文字表示这个化学反应,并在相应物质名称下边写出它的化学式
_______________________________________________________________________________________
六、计算题
40.1 t尿素[CO(NH2)2]和多少t碳酸氢铵[NH4HCO3]所含氮元素的质量相等
41.已知硫酸铵的化学式为[(NH4)2SO4],试计算
(1)硫酸铵中N、H、S、O的原子个数比及质量比;
(2)氮元素的质量分数。
参考答案
一、1.D 2.C 3.C 4.C 5.D 6.C 7.C 8.C 9.D 10.B 11.B 12.A(提示:原子的质量比等于相对原子质量之比,所以乙的相对原子质量为=12![]()
![]() =15。则甲的相对原子质量=15
=15。则甲的相对原子质量=15![]() =10。)13. D(提示:微粒可以是原子,离子如OH-和F-等)
14.C 15.C 16.C 17.A(提示:相同数目的分子质量比等于式量之比。) 18.B 19.C 20.B
=10。)13. D(提示:微粒可以是原子,离子如OH-和F-等)
14.C 15.C 16.C 17.A(提示:相同数目的分子质量比等于式量之比。) 18.B 19.C 20.B
二、21.B 22.C、D 23.A、C 24.C(提示:根据混合物氧元素的质量分数=![]()
![]() 100%=45%,氧化镁中氧元素的质量分数=
100%=45%,氧化镁中氧元素的质量分数=![]() 100%
= 40%,则另一氧化物中含氧元素的质量分数应大于45%,所以是Al2O3。) 25.D(提示:求出每千克氮元素所需要的金额最小的。) 26.C、
100%
= 40%,则另一氧化物中含氧元素的质量分数应大于45%,所以是Al2O3。) 25.D(提示:求出每千克氮元素所需要的金额最小的。) 26.C、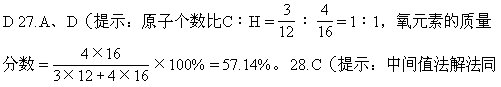
28题,因为一氧化碳中氧元素的质量分数为57.14%大于55%,则另一物质中氧元素的质量分数应小于55%即为SO2。) 29.D(提示:如白磷和红磷组成物质就是两种磷单质的混合物。) 30.A、D
三、31.(1)⑤⑧(2)①②③④⑥⑦⑨(3)③⑦(4)①②④⑥⑨(5)③⑦(6)②⑨32.O2 32;28 氮气;KCl 74.5;232 四氧化三铁;MnO2 87;122.5 氯酸钾;He 4;197 锰酸钾;P2O5 142;40氧化镁。33.④;②;①;③。34.(1)一个水分子中含有2个氢原子或每一个水分子中含有2个氢原子;(2)2个铜原子。(3)2个氢分子,每个氢分子中含有2个氢原子。(4)2个三氧化硫分子。(5)2个氢原子。
35.(1)氧气;Zn;O2;ZnO。(2)氧化汞;HgO;Hg;O2。(3)硫;S;O2;SO2;(4)氯酸钾;KClO3;MnO2;KCl;O2。
四、36.(1)因为分子是在不停地运动着的,长期放置在敞口容器中氧气便扩散到空气中,空气中的气体也扩散到容器中。
(2)因为太阳晒着的地方温度较高,分子运动速度较快,分子间的间隔也增大,水就容易变为气态而扩散到空气中,湿衣服更易晾干。
37.(1)每个氧化汞分子分解成一个汞原子和一个氧原子,氧原子和汞原子各自重新组合成氧分子和金属汞。
(2)在化学反应中分子可分解成原子,而原子却不能再分;原子是化学变化中的最小微粒。
38.答:氧原子个数多。因为氧原子的相对原子质量(16)比铁(56)小。所以一个氧原子的质量比一个铁原子小,故等质量的氧原子和铁原子,氧原子个数比铁原子多。
五、39.(1)碱式碳酸铜,Cu2(OH)2CO3。
(2)碱式碳酸铜氧化铜+水+二氧化碳Cu2(OH)2CO3,CuO,H2O,CO2
六、40.解.1t尿素中含氮元素的质量为
![]()
含0.467t氮元素的碳酸氢铵质量为:
![]()
41.解:(1)由化学式(NH4)2SO4可知
原子个数比,N∶H∶S∶O=2∶8∶1∶4
质量比N∶H∶S∶O=28∶8∶32∶64=7∶2∶8∶16。 ![]()