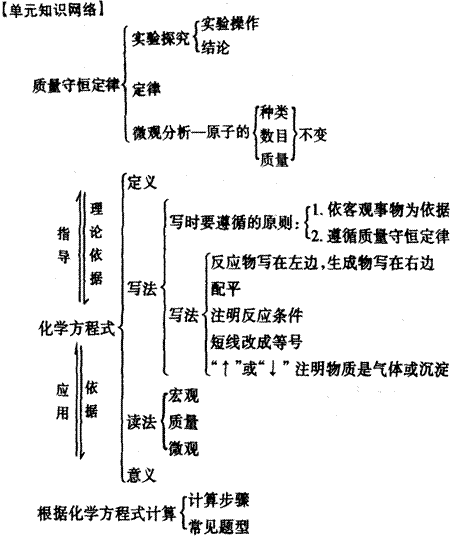
 第五单元 化学方程式
第五单元 化学方程式
1.物质发生化学反应时,肯定有变化的是 ( )
A.原子的数目 B.物质的质量之和 C.分子种类 D.元素种类
2.加热mg KClO3和ng MnO2的混合物,反应一段时间后,得残留固体wg,则生成氧
气的质量为 ( )
A.(m-n-w) B.(m+n-w) C.w-n D.w-m
3.正确表示铜在空气中加热生成氧化铜的化学方程式是 ( )
 | |||
4.电解水:2H2O 2H2↑+O2↑该反应中,水、氢气、氧气的质量比为 ( )
![]() A.2:2:1
B.18:2:36 C.9:1:8 D.18:4:16
A.2:2:1
B.18:2:36 C.9:1:8 D.18:4:16
5.化学方程式:S+O2 SO2的正确读法是 ( )
A.硫和氧气的分子在点燃的条件下生成二氧化硫分子
B.硫和氧气分子在点燃条件下生成二氧化硫
C.硫和氧气在点燃条件下反应生成二氧化硫
D.每一个硫原子和一个氧分子在点燃条件下生成一个二氧化硫分子
6.碳在氧气中燃烧,下列说法符合质量守恒定律的是 ( )
A.2g碳和4g氧气生成6g二氧化碳 B.3g碳和8g氧气生成11g二氧化碳
C.4g碳和5g氧气生成9g二氧化碳 D.5g碳和9g氧气生成14g二氧化碳
7.在4NH3+5O2=4X+6H2O反应中,X的化学式是 ( )
A.NO D.NO2 C.N2O4 D.N2
8.在反应A+4B==3C+D中,若反应物质量比WA:WB==7:3,现已知反应生成23gC和27gD,则反应消耗的A和B的质量分别是 ( )
A.28g、22g B.35g、15g C.22g、28g D.42g、18g
9.2g氢气和2g氧气在点燃条件下充分反应,能生成水 ( )
A.18 g B.4.5 g C.2.25 g D.36 g
10.某可燃物X在空气中燃烧的变化如下:X+O2→CO2+H2O则X物质的组成为 ( )
A.只含碳元素 B.只含碳、氢两种元素
C.既含碳、氢元素,又含氧元素 D.肯定含碳、氢元素,可能含氧元素
11.在化学反应A+B==C+D中,8gA与16gB恰好完全反应生成10gC,若12gA参加反应,生成D的质量是 ( )
A.20g B.24g C.15g D 21g
12.Mg锌与足量的盐酸反应中,生成Ng氢气,则锌的相对原子质量是 ( )
A.2N/M B.MN/2 C.2M/N D.2/MN
13.在X+Y==Z+W反应中,若20gX和15gY恰好完反应生成5gW,且Z的相对分子质量为60,则X的相对分子质量是 ( )
A.40 B.50 C.60 D.70
14.物质发生化学变化时,都要遵守_________定律,其内容是____________质量总和等于 ____________质量总和。其实质是参加反应的各物质(反应物)的__________,重新组合生成其他物质(生成物),在反应前后______________没有改变,__________没有增减,_______也没有变化。
15.利用物质的__________表示物质_______________的式子叫做化学方程式。书写化学方程式时,必须注意两个原则,一是必须___________为基础,二是要符合__________定律。进行化学方程式的配平时,应在式子左、右两边的化学式_______配上适当的系数,绝不能改动化学式_______的数字。
1.下列现象可用质量守恒定律解释的是 ( )
A.10g水受热变成10g水蒸气
B.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
C.铁在空气中灼烧后,质量增加 D.蜡烛受热熔化,冷却后质量不变
2.根据质量守恒定律可以推知,铝箔在氧气中燃烧后,生成物的质量 ( )
A.一定等于铝箔的质量 B.一定小于铝箔的质量
C.一定大于铝箔的质量 D.无法确定质量大小
3.下列各叙述中,错误的是 ( )
A.化学反应前后,物质的质量总和相同 B.化学反应前后,元素的种类相同
C.化学反应前后,各种原子的总数相同 D.化学反应前后,物质的分子个数相同
4.镁在氧气中燃烧生成氧化镁,这个反应中,镁、氧气、氧化镁的质量比是 ( )
A.24:32:56 B.24:32:40 C.48:32:80 D.48:32:64
5.一种可作绿色能源的物质X,其燃烧的化学方程式为X+ 2O2 点燃 CO2+2H2O根据
质量守恒定律判断,X的化学式是 ( )
A.H2 B.CH3OH C.CH4 D.C2H5OH
 6.已知反应3A+2B=2C+D,A、B两物质完全反应时,质量比为3:4。若生成C和D共140g,则该反应消耗B的质量为
( )
6.已知反应3A+2B=2C+D,A、B两物质完全反应时,质量比为3:4。若生成C和D共140g,则该反应消耗B的质量为
( )
A.60g B.80g C.90g D.120g
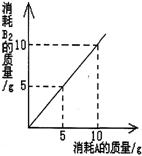
7.在化学反应A+B=AB2中。A与B2反应的
质量关系如右图所示。将8gA与10gB2充分反
应,则生成AB2的质量是 ( )
A.10g B.3g C.16g D.18g
8.氢气和氧气的混合物气体Wg在密闭容器中用电火花点燃,充分反应后冷却到室温,得水9g,并有1g气体剩余,则原Wg混合气体中氧气的质量可能为 ( )
A.6g B.7g C.5g D.8g或9g
9.有A、B、C三种物质各15g,在一定条件下,充分反应只生成30gD。若增加10gC,A与C恰好完全反应。则参加反应的A与B的质量比是 ( )
A.2:3 B.3:2 C .5:2 D.5:3
10.写出下列反应的化学方程式,并注明基本反应类型
(1)铁丝在氧气中燃烧 _____________________________________________( )
(2)高锰酸钾受热分解______________________________________________( )
(3) 水通直流电生成氢气和氧气____________________________________ ( )
(4)过氧化氢溶液在二氧化锰作用下分解______________________________( )
(5)镁带在氧气中燃烧______________________________________________( )
(6)甲烷(CH4)在氧气中燃烧__________________________________________( )
(7)氢气还原氧化铜_________________________________________________( )
11.在一些胃药中,常常含有氢氧化铝:[Al(OH)3]的成份,它在人的胃内起的作用是________;其反应的化学方程式为:______________________________。
12.家用的白炽灯泡里放有极少量的红磷,其作用是做脱氧剂延长灯泡的使用寿命其作用的化学方程式为: :反应的基本类型为 。气体打火机中充入的丁烷化学式是C4Hl0,它充分燃烧生成水和二氧化碳。该反应的化学方程式是________________________________。
13.锌和盐酸(HCl)反应生成氢气和氯化锌。实验室里用3.7g锌与足量的盐酸反应,可制得氢气和氯化锌的质量各是多少?
14.剧烈运动后,人体产生了乳酸(C3H6O3)。经过一段时间放松,由于乳酸和氧气反应生成水和二氧化碳,酸胀感逐渐消失。写出这一反应的化学方程式,并计算消除体内360g乳酸需要多少克氧气?同时呼出CO2多少克?
15.(7分)150g稀盐酸跟一定量含少量杂质的石灰石恰好完全反应(杂质不溶解,也不参与反应),生成11g二氧化碳。回答下列问题:
(1)写出稀盐酸跟石灰石反应的化学方程式________________________________。
(2)求反应后所得的溶液中溶质的质量分数(保留为0.1%)。