初三化学第七章(应用广泛的酸、碱、盐)检测题
相对原子质量:F-56 Mg-24 H-1 O-16 C-12 N-14 Na-23 Cl-35.5
一、选择题(每题只有1个符合要求的答案。2分×15=30分)
1、下列物质①干燥的食盐晶体 ②液态氯化氢 ③硝酸钾溶液 ④稀硫酸 ⑤蔗糖溶液 ⑥酒精,分别装入容器做导电实验,灯泡会发光的物质是( )
A、①②③④ B、③④ C、全部都发光 D、全部不发光
2、在某些食品“干燥剂”袋内装有氧化钙固体,氧化钙属于( )
A、酸 B、碱 C、盐 D、氧化物
3、一些食物的近似pH如下:葡萄汁3.5~4.5;苹果汁2.9~3.3;牛奶6.3~6.6;鸡蛋清7.6~8.0,则下列说法中,不正确的是( )
A、牛奶比苹果汁的酸性强 B、苹果汁能使石蕊试液变红色
C、鸡蛋清为碱性食品 D、胃酸过多的人应少饮葡萄汁
4、钾肥可以增强农作物的抗倒伏能力,下列可用作钾肥的是( )
A、尿素 B、碳铵 C、硫铵 D、草木灰
5、在滴有石蕊试液的碳酸钠溶液中,加入过量盐酸,加盐酸前后溶液的颜色依次为( )
A、紫色、红色 B、红色、蓝色 C、蓝色、红色 D、红色、无色
6、下列各物质分别久置于敞口的容器中,其质量增加但不变质的是( )
A、浓盐酸 B、浓硫酸 C、Na2CO3 D、NaOH固体
7、用pH试纸测定白醋的酸度时,如果先将试纸用蒸馏水润湿,再把白醋滴到试纸上,则测得的结果与白醋实际的pH比较( )
A、偏低 B、偏高 C、相等 D、无法比较
8、氯化钙溶液中含少量盐酸,在没有指示剂的条件下中和盐酸使溶液呈中性可选用( )
A、熟石灰 B、生石灰 C、石灰石 D、纯碱
9、能用于证明锌、铜、银的金属活动性顺序的一组试剂是( )
A、铜、银、硝酸锌溶液 B、锌、稀盐酸、硝酸铜溶液、银
C、锌、铜、稀硫酸、硝酸银溶液 D、锌、铜、银、稀硫酸
10、在5.6g混有少量铜粉的铁粉中加入足量稀硫酸,产生氢气的质量( )
A、小于0.2g B、等于0.2g C、大于0.2g D、无法确定
11、下列关于酸、碱、盐的元素组成的说法中,正确的是( )
A、酸、碱、盐可能都不含金属元素 B、酸、碱一定含氢元素,盐一定不含氧元素
C、碱、盐可能含氧元素,酸一定不含氧元素 D、盐一定含金属元素,酸、碱不一定含金属元素
12、现榨的苹果汁在空气中会由淡绿色变为棕黄色。你猜测其原因可能是( )
A、苹果汁中的Fe2+变成Fe3+ B、苹果汁中含有Cu2+
C、苹果汁中含有OH- D、苹果汁中含有Na+
13、下列实验方案中,能达到预期目的的是( )
A、用NaOH溶液除CO2中混有的HCl气体 B、用点燃的方法除去CO中混有的少量CO2
C、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是碳酸钙和氢氧化镁)
D、用BaCl2溶液除去KNO3溶液中混入的少量K2SO4,得到纯净的KNO3溶液
14、由金属单质与稀盐酸直接反应,不能生成的盐是( )
A、FeCl2 B、FeCl3 C、MgCl2 D、AlCl3
15、将1g生石灰放入50mL饱和石灰水中,搅拌并冷却到原来温度,下列说法正确的是( )
A、溶剂质量不变 B、溶质质量增加 C、溶液浓度不变 D、溶解度增大
二、选择题(每题有1~2个答案。少选且正确得分2分,多选0分。3分×5=15分)
16、在氯化铝和硫酸铝的混合溶液中,已知铝离子和氯离子个数比为5:3,若溶液中铝离子数为5n时,则硫酸根离子的个数约为( )
A、8n B、4n C、6n D、2n
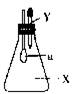 17、右图所示的锥形瓶内充满气体X,胶头滴管内盛有液体Y,挤压胶头滴管,使液体Y进入瓶中,振荡,一会儿可见套在玻璃管下端的小气球a鼓起。气体X和液体Y可能是( )
17、右图所示的锥形瓶内充满气体X,胶头滴管内盛有液体Y,挤压胶头滴管,使液体Y进入瓶中,振荡,一会儿可见套在玻璃管下端的小气球a鼓起。气体X和液体Y可能是( )
A、X是CO2,Y是KOH溶液 B、X是CO2,Y是稀硫酸
C、X是HCl,Y是AgNO3溶液 D、X是CO,Y是石灰水
18、下列物质溶与水后,其水溶液分别能与铁、氯化钡溶液、烧碱溶液反应的是( )
A、浓盐酸 B、三氧化硫 C、氧化钙 D、硫酸铜
19、在下列溶液中分别放入锌片,一段时间后把锌片取出,溶液质量增加的是( )
A、氯化镁溶液 B、盐酸 C、硫酸亚铁溶液 D、硝酸银溶液
20、X、Y、Z三种金属,把Y投入XCl2溶液中,Y溶解后溶液的质量增加;把X投入Z(NO3)2溶液中,X溶解后溶液的质量减少。下列判断中正确的是( )
A、金属活动性:X>Y>Z B、相对原子质量:Y>Z>X
 C、X、Y、Z可能依次是Cu、Zn、Hg D、X、Y、Z可能依次是Hg、Zn、Cu
C、X、Y、Z可能依次是Cu、Zn、Hg D、X、Y、Z可能依次是Hg、Zn、Cu
三、填空题(本题共27分)
21、(1分)化学晚会上,小是将一经滤纸贴在黑板上然后依次向滤纸上喷洒A、B两种无色试剂。当喷洒A时,白色的滤纸上出现了一只红色的月季花(右图);再喷洒B时,红色的月季花又逐渐消失。假若B是稀盐酸,则 A可能是_________。(只填一种)
22、(4分)向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,充分反应后过滤,得到固体不溶物A和滤液。将A放入少量稀硫酸中,有气体产生。则A中一定含有__________,可能含有____________;滤液中一定含有的溶质是____________。
23、(2分)在硝酸银溶液中加入盐A的溶液,产生白色沉淀。过滤后向滤渣中滴加稀硝酸,沉淀不溶解;在滤液中再加入钠盐B的溶液,又产生白色沉淀。过滤后向滤渣中滴加稀硝酸,沉淀不溶解。则A为___________;B为_________。
25、(8分)实验室中有KMnO4、O2、Mg、稀盐酸、Ca(OH)2五种物质,请你以它们为反应物,按下表的要求各写出一个化学方程式。
| 基本反应类型 | 化学方程式 |
| 化合反应 | |
| 分解反应 | |
| 置换反应 | |
| 复分解反应 |
26、(8分)某金属冶炼厂的管道烟泥中含有某些金属,随机取样对烟泥进行分析。
由下表中的数据可知,在烟泥中含有的铜、锌以及能造成污染的硫。因此从效益和环保角度出发应考虑把铜、锌回收利用,并对硫进行适当的处理。
| 编号 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |
[设计方案]
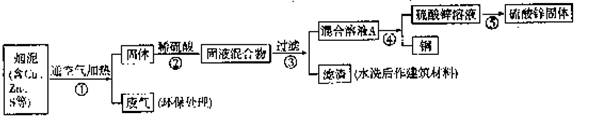
⑴步骤①②中含铜元素的物质发生反应的化学方程式:
①_______________________、②____________________
⑵写出本方案中处理废气的方法(用化学方程式表示):_____________________。
⑶步骤⑤中所用的操作方法是:__________________________。
⑷在步骤④中,可选用试剂____________从混合溶液A中得到铜。
24、(4分)某园林工人配制波尔多液时,将胆矾(CuSO4·5H2O)晶体、生石灰(CaO)分别与水按1:50的质量比混合(胆矾溶于水得到CuSO4溶液),然后把得到的两种液体在木桶里混合并充分搅拌。⑴两种液体在木桶里反应的化学方程式为____________________;⑵若要检验所配的波尔多液中是否还含有CuSO4,实验方法是_______________。
四、简答题(本题共6分)
27、(3分)雨水的酸碱度可以反映大气受硫的氧化物或氮的氧化物污染的情况。请你设计一个实验,测定当地一次降雨时雨水的酸碱度,写出⑴实验用品;⑵实验步骤。
28、(3分)有一瓶固体氯化钾,其中含有少量氯化钡。某同学取出一部分,将它溶于水溶液,并分装在甲、乙两支试管中,进行以下实验:实验一:在甲试管中逐滴加入稀硫酸,至不再产生沉淀,过滤,在滤液中加入氢氧化钾溶液至中性,加热浓缩,冷却得到固体A。实验二: 在乙试管中逐滴加入碳酸钾溶液,至不再生成沉淀,过滤,在滤液中加入盐酸至酸性,加热浓缩,冷却得到固体B。
请回答哪一实验方法制得的氯化钾纯一些?为什么?
五、实验题(本题共12分)
29、(5分)(每空1分)一包白色粉末可能由碳酸钠、硫酸钠和氯化钠中的2种或3种组成。经实验得知其中肯定含有碳酸钠和硫酸钠。为了确定是否含有氯化钠,某同学设计了以下实验。请该同学的思路填写下表:
| 实验操作步骤 | 实验目的、现象及结论 |
| ⑴取少量白色固体粉末,配成水溶液,向其中加入足量的稀酸A,A为___________ | 除去____________________ |
| ⑵继续加入足量的B,B为___________ | 除去硫酸钠 |
| ⑶向⑵中的滤液中加入C,C为__________溶液 | 若有_________,证明原白色固体粉末中肯定含有氯化钠;否则不含氯化钠 |
30、(7分)现有盐酸、氢氧化钙、碳酸钠三种溶液,请你从中选择两种溶液,用化学方法进行鉴别。要求:①选择试剂时,同类物质在鉴别中只能使用一次;②每次鉴别一步完成;③有微溶物生成的,不按沉淀处理。请回答:
⑴你认为鉴别方法最多的两种溶液是:_________________________________
⑵鉴别上述两种溶液,你所选择的试剂分别是:__________________
⑶填写用上述任意一种试剂鉴别这两种溶液的实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
六、对碱有关问题的探究(本大题共10分)
31、⑴(2分)某同学进行家庭小实验,需要少量氢氧化钠溶液,他用买来的纯碱和熟石灰,制得了氢氧化钠溶液,请你写出化学方程式: ________________________。
⑵(2分)某同学进行制作“叶脉书签”小实验,他将一片具网状叶脉的树叶洗净后,放在约10%的氢氧化钠溶液中煮沸,当叶肉呈黄色后取出用水洗净,再用软牙刷慢慢刷去叶肉,再次用水清洗后晾干,夹在书中压平。该实验中他利用了氢氧化钠_________的性质。进行实验时,他应当注意___________________。
⑶(2分)在化工生产中,原料往往不能全部转化为产品。工业上常用电解纯净的饱和食盐水的方法制得烧碱溶液,再经过浓缩、蒸发等步骤,最后得到固体烧碱。请推测在空所中放置一段时间的烧碱样品中,可能含有的杂质是:_____________________。
⑷(2分)我国东南沿地区某镇的乡镇企业比较发达。他们办有造纸厂、精炼铜厂、海水晒盐厂和硫酸生产厂,经环保局对各厂排放的污水检验获知:①造纸厂排放的污水主要含有NaOH;②精炼铜厂排放的污水主要含有CuCl2;③海水晒盐厂排放的污水主要含有MgSO4;④硫酸厂排放的污水主要含有H2SO4。假若现有①NaOH、②CuCl2、③MgSO4、④H2SO4四种溶液,不用任何试剂依次鉴别出的顺序为(用序号填写)___________。
⑸(2分)向40g 5%的NaOH溶液中,加入60g的NaOH溶液,混合后的溶液中NaOH的质量分数为__________;上述混合溶液恰好能跟_________g 10%的稀硫酸完全反应。
参 考 答 案
1、B 2、D 3、A 4、D 5、C 6、B 7、B 8、C 9、C 10、A 11、A 12、A 13、C 14、B 15、C 16、C 17、AC 18、BD 19、BC 20、C 21、酚酞试液(或NaOH、KOH等溶液)(只填一种) 22、Fe、Cu,Zn;ZnSO4 23、氯化钡(或BaCl2)硫酸钠(或Na2SO4) 24、⑴Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓ ⑵将一根光亮的铁丝插入波尔多液中,观察铁丝表面是否变红 25、
| 基本反应类型 |
| ||
| 化合反应 |
| ||
| 分解反应 | 2KMnO4===K2MnO4+MnO2+O2↑ | ||
| 置换反应 | Mg+2HCl===MgCl2+H2↑ | ||
| 复分解反应 | Cu(OH)+2HCl===CuCl2+2H2O |
26、⑴①2Cu+O2==2CuO ②CuO+H2SO4==CuSO4+H2O ⑵2NaOH+SO4==Na2SO4+H2O ⑶蒸发结晶(或蒸发、浓缩、结晶) ⑷Zn 27、实验用品:烧杯、滴管、pH试纸(1分)实验步骤:①用烧杯采集雨水样品一份 ②取一条pH试纸,用滴管吸取少量待测水样,滴在pH试纸上,把试纸颜色跟比色卡对比,得到水样的酸碱度。(2分) 28、(3分)第二种方法纯些。因为第一种方法中加入硫酸只有略过量才不再产生沉淀,使最终所得固体A中含有K2SO4;第二种方法中过量的碳酸钾被盐酸除掉而转化成KCl,多余的盐酸在蒸发过程中以HCl气体挥发掉。 29、⑴HNO3(或H2SO4)Na2CO3 ⑵Ba(NO3)2 ⑶AgNO3白色沉淀 30、⑴(2分)可能有三种情况 ⑵(3分)可能出现的答案及得分见下表
| 问题⑴中可能的两种溶液 | 得分 | 问题⑵的各种鉴别方法中所加试剂(写具体物质也可) | 得分 |
| HCl、Na2CO3 | 2 | ①指示剂 ②活泼金属③CuO或Fe2O3等④酸(HCl、H2SO4)⑤难溶碱或Ca(OH)2,Ba(OH)2⑥碳酸盐 | 写出6类物质3分 写出5类物质2分 写出4类物质1分 |
| HCl、Cu(OH)2 | 1 | ①指示剂 ②活泼金属 ③CO2或CuO、Fe2O3等 ④难溶碱 ⑤碳酸盐 | 写出5类物质2分 写出4类物质1分 |
| Na2CO3、Cu(OH)2 | 1 | ①CO2 ②酸(HCl,H2SO4等) ③Ca(OH)2,Ba(OH)2 ④可溶性碳酸盐或可溶性钙盐、钡盐等 | 写出4类物质1分 |
⑶(2分)只要用所选择的试剂填写实验报告,意见基本表达清楚,即给2分。若有现象,结论有一种不清楚,给1分。 31、⑴Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ ⑵有强烈腐蚀性在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀 ⑶NaCl、Na2CO3(只答一种杂质不给分) ⑷②①③④或②①④③ ⑸8% 98