天津市河西区2004--2005学年度第二学期九年级第二次质量调查
化学试题
第I卷(选择题 共2大题 共30分)
可能用到的相对原子质量H 1 C 12 O 16
一. 选择题(本大题共10题,每小题2分,共20分)每小题给出的四个选项中,只有一个最符合题意。请将正确的选项填入题后括号内。
1. 在汽油中加入适量酒精作为汽车燃料,可节省石油资源,减少汽车尾气的污染。关于酒精的下列说法中,有错误的是( )
A. 高粱、玉米和薯类等经过发酵、蒸馏,得到酒精,这个过程中,只发生了化学变化
B. 酒精是乙醇的俗称,它属于有机物,化学式为![]()
C. 酒精在空气中充分燃烧,产物是二氧化碳和水
D. 酒精燃烧不充分产生的一氧化碳会污染空气
2. 下列说法中,错误的是( )
A. 同种物质的分子性质相同,不同种物质的分子性质不同
B. 在水电解的反应中,氢原子和氧原子都没有发生变化
C. 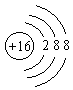 与
与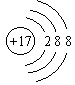 示意的是不同元素的粒子结构
示意的是不同元素的粒子结构
D. 同种原子可以结合成分子,不同种原子不能结合成分子
3. 近年来,乳酸(化学式为![]() )成为人们研究的热点之一。乳酸在医药、食品等工业中应用前景广阔。人在剧烈运动后,血液中会产生较多的乳酸,使肌肉酸痛。放松一段时间后,由于乳酸与吸入的氧气反应生成二氧化碳和水,使肌肉的酸痛感消失。下列有关乳配的叙述中,完全正确的是()
)成为人们研究的热点之一。乳酸在医药、食品等工业中应用前景广阔。人在剧烈运动后,血液中会产生较多的乳酸,使肌肉酸痛。放松一段时间后,由于乳酸与吸入的氧气反应生成二氧化碳和水,使肌肉的酸痛感消失。下列有关乳配的叙述中,完全正确的是()
A. 乳酸中碳、氢、氧三种元素的质量比为![]()
B. 乳酸属于有机物,它是由3个碳原子、6个氢原子和3个氧原子构成
C. 乳酸是一种氧化物,每个分子中共有12个原子核
D. 乳酸与氧气反应的化学方程式为:![]()
4. 一些食物的近似![]() 如下:葡萄3.5~4.5,苹果2.9~3.3,牛奶6.3~6.6,鸡蛋清7.6~8.0,则下列说法正确的是()
如下:葡萄3.5~4.5,苹果2.9~3.3,牛奶6.3~6.6,鸡蛋清7.6~8.0,则下列说法正确的是()
A. 胃酸过多的人宜多食苹果
B. 葡萄汁能使紫色石蕊试液变红
C. 牛奶和鸡蛋清均为碱性食物
D. 苹果汁的酸性比葡萄汁弱
5. 恒温下,氯化钠的饱和溶液露置在空气中一段时间后,有少量固体析出,则下列说法中,正确的是( )
A. 氯化钠的溶解度变小
B. 溶液中氯化钠的质量分数变小
C. 溶液中溶剂的质量变小
D. 溶液变成不饱和溶液
6. 铁的应用在我国已有很久的历史。下列有关铁的知识的叙述不正确的是( )
A. 铁具有良好的导电性、导热性
B. 铁在潮湿的空气中能形成致密的氧化物保护膜
C. 生铁和钢的主要成分都是铁
D. 铁制容器不能盛放硫酸铜溶液
7. 食盐、食醋、纯碱均为家庭厨房中常用的物质,利用这些物质及自来水、鸡蛋壳、铝壶中的水垢能完成的实验是( )
① 检验自来水中是否含氯离子
② 鉴别食盐和纯碱
③ 检验鸡蛋壳能否溶于酸
④ 除去铝壶中沉积的水垢(主要成分是碳酸钙和氢氧化镁)
A. ①② B. ①③ C. ①④ D. ②③④
8. 根据下图所示的转化关系,推断物质X可能是( )
![]()
A. CuO B. ![]() C.
C. ![]() D.
D.![]()
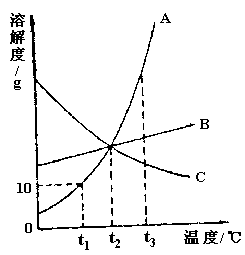
9. 下图是A、B、C三种固体物质的溶解度曲线。下列叙述正确的是( )
A. 三种物质的溶解度大小顺序为![]()
B. ![]() 时,A的饱和溶液中溶质的质量分数为10%
时,A的饱和溶液中溶质的质量分数为10%
C. 将![]() 的C的饱和溶液降温到
的C的饱和溶液降温到![]() 时,变成不饱和溶液
时,变成不饱和溶液
D. 将![]() 的A的饱和溶液升温到
的A的饱和溶液升温到![]() 时,有晶体析出
时,有晶体析出
10. 下列实验操作中,正确的是( )
A. 给试管里的固体加热,先进行预热
B. 稀释浓硫酸时,把水迅速地倒入浓硫酸中,并不断搅动
C. 向试管中滴加液体时,滴管紧贴试管内壁
D. 称量氢氧化钠固体时,直接将其放在托盘天平左盘的滤纸上
二. 选择题(本大题共5题,每小题2分,共10分)每小题给出的四个选项中,有1~2个符合题意。请将正确的选项填入题后括号内。只有一个选项符合题意的多选不给分;有2个选项符合题意的只选一个且符合题意给1分,若选2个有一个不符合题意则不给分。
11. 氧化银钮扣电池常用于手表和计算机,电池内的总反应可以表示为:![]()
![]() 。关于该反应的下列说法正确的是( )
。关于该反应的下列说法正确的是( )
A. 该反应属于化合反应
B. 该反应属于复分解反应
C. 该反应属于置换反应
D. 该反应中银元素的化合价升高
12. 用X表示某化合物的化学式,X燃烧时发生如下反应:![]() 由此,下列说法中,正确的是(
)
由此,下列说法中,正确的是(
)
A. X仅由碳、氢两种元素组成
B. X的相对分子质量为64
C. X中碳元素的质量分数为37.5%
D. 反应中,X与O2的质量比为![]()
13. 分别将下列各组物质同时放入足量水中,一定有两种不溶物生成的是( )
A. ![]()
B. ![]()
C. ![]()
D. ![]()
14. 无色气体可能由![]() 、
、![]() 及
及![]() 中的一种或几种组成。如果将该气体通过灼热的氧化铜粉末,再通入澄清石灰水,可以看到黑色粉末变为光亮的红色物质,且澄清石灰水变浑浊。则对该气体的组成描述正确的是()
中的一种或几种组成。如果将该气体通过灼热的氧化铜粉末,再通入澄清石灰水,可以看到黑色粉末变为光亮的红色物质,且澄清石灰水变浑浊。则对该气体的组成描述正确的是()
A. 一定含有一氧化碳
B. 一定含有碳的氧化物
C. 一定是氢气和碳的氧化物的混合物
D. 可能是氢气和碳的氧化物的混合物
15. 某气体在氧气中充分燃烧后的产物依次通过浓硫酸和氢氧化钠溶液,经完全吸收后,测得浓硫酸和氢氧化钠溶液增加的质量之比为![]() ,则该气体可能是(
)
,则该气体可能是(
)
A. ![]() B. CO和H2的混合气体
B. CO和H2的混合气体
C. ![]() D. CH4和CO的混合气体
D. CH4和CO的混合气体
第II卷(非选择题 共5大题 共70分)
可能用到的相对原子质量H 1 C12 N14 O16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Ba 137
三.(本大题共6题 共17分)
16.(6分)下列物质① 食盐 ② 酒精 ③ 金刚石 ④ 稀硫酸 ⑤ 氧气 ⑥ 碳酸钠在生产生活中有广泛用途。请按以下要求填空。(填序号)
(1)炼钢时,将生铁中所含的过量的碳变为气体而除去,使用的是 。
(2)装在钻探机的钻头上,用来钻凿坚硬岩层的是 。
(3)可将碘溶于 中,制成医用消毒剂。
(4) 可用于调味和腌渍蔬菜。
(5) 可用来除去铁器表面的铁锈。
(6)家庭里蒸馒头或洗涤衣物,有时用到 。
17.(2分)上海已建成我国第一条磁悬浮铁路。磁悬浮的核心技术是利用超导体的反磁性。高温超导物质(![]() )是以
)是以![]() (Y为元素钇的符号)、
(Y为元素钇的符号)、![]() 和
和![]() 为原料,经研磨烧结而成(此过程中所有元素的化合价均不变)。
为原料,经研磨烧结而成(此过程中所有元素的化合价均不变)。![]() 中的Y的化合价为 ,
中的Y的化合价为 ,![]() 的化学式为
。
的化学式为
。
18.(1分)最新科技报道,夏威夷联合天文中心的科学家在宇宙中发现了氢元素的一种新粒子,它的组成可用![]() 表示。已知氢的原子结构示意图为
表示。已知氢的原子结构示意图为![]() ,1个
,1个![]() 粒子中含有
粒子中含有
个质子, 个电子。
19.(2分)一氧化氮是大气的主要污染物之一。近年来又发现生物体内存在少量一氧化氮,它有扩张血管、增强记忆力的功能,成为当今生命科学研究的热点。工业上制得一氧化氮的反应为:![]() ,则X的化学式为 ,它的水溶液呈 性(选填“酸”、“碱”或“中”)。
,则X的化学式为 ,它的水溶液呈 性(选填“酸”、“碱”或“中”)。
20.(2分)纳米(nm)是一个长度单位(1m=109nm)。纳米材料和纳米技术的应用涉及现代生产和生活的各个方面。用纳米级的某种氧化物作催化剂,使汽车尾气中的CO和NO反应,并转化为两种气体,其中一种可参与绿色植物的光合作用,另一种是空气中含量最多的气体。这两种气体分别是 和 。
21.(4分)氢气是一种绿色能源,以它为燃烧的电池正逐渐被应用到人们的生活之中。有许多方法可以得到氢气,请写出其中一种方法(以化学方程式表示,该反应为置换反应):
。科学家们最新研制出利用太阳能产生激光,再利用激光使水分解得到氢气的新技术,在水分解时,![]() (二氧化钛)作催化剂,请写出水在此相应条件下分解的化学方程式:
。
(二氧化钛)作催化剂,请写出水在此相应条件下分解的化学方程式:
。
四.(本大题共2题 共16分)
22.(8分)请从锌、氧气、三氧化硫、水、盐酸、氢氧化钡溶液、硫酸铜溶液、高锰酸钾中选出适当的物质作反应物,按下列要求写出有关反应的化学方程式。
(1)生成酸的化合反应
(2)生成物中含氧化物的分解反应
(3)生成金属单质的置换反应
(4)中和反应
23.(8分)A、B、C、D、E五种化合物都含有钙元素,依据下图中各物质间的转化关系,写出①~④中各步反应的化学方程式。
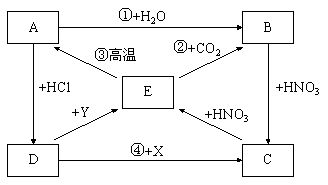
①
②
③
④
五.(本大题共3题 共12分)
24.(3分)欲用化学方法除去下表物质中所含有的少量杂质,请将选用的试剂(适量)填入表中。
| 物质 | 杂质 | 除去杂质时应选用的试剂 |
| 干燥的 |
|
|
|
|
|
|
| 硝酸 | 盐酸 |
|
25.(6分)镁是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
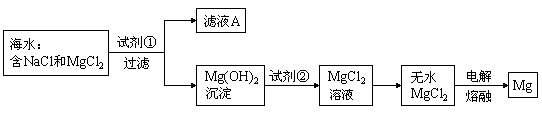
(1)为了使![]() 转化为
转化为![]() ,试剂①可以选用
,要使
,试剂①可以选用
,要使![]() 完全转化为沉淀,加入试剂①的量应过量,确认所加试剂①已过量的方法是
。
完全转化为沉淀,加入试剂①的量应过量,确认所加试剂①已过量的方法是
。
(2)加入试剂①后,能够分离得到纯净![]() 沉淀的操作方法为过滤、
、干燥。
沉淀的操作方法为过滤、
、干燥。
(3)试剂②可以选用 。
(4)无水![]() 在熔融状态下通电后会产生
在熔融状态下通电后会产生![]() 和
和![]() ,写出该反应的化学方程式:
,写出该反应的化学方程式:
。
26.(3分)有一包粉末,可能含有碳酸钙、硫酸钠、碳酸钠、硫酸铜、氯化钠、硝酸钡中的一种或几种。以下是某同学进行实验并观察到的现象:
(1)取少量粉末放入试管中,加水、振荡、静置、过滤,得白色沉淀和无色滤液;
(2)向白色沉淀中加入足量的稀硝酸,白色沉淀全部溶解;
(3)将无色滤液分成两份,分别加入稀硫酸、硝酸银溶液,都有白色沉淀生成。由此推断,这包粉末的可能组成是:
① 。
② 。
③ 。
六.(本大题共2题 共13分)
27.(11分)用下图中的仪器和装置填空,或按要求回答问题:
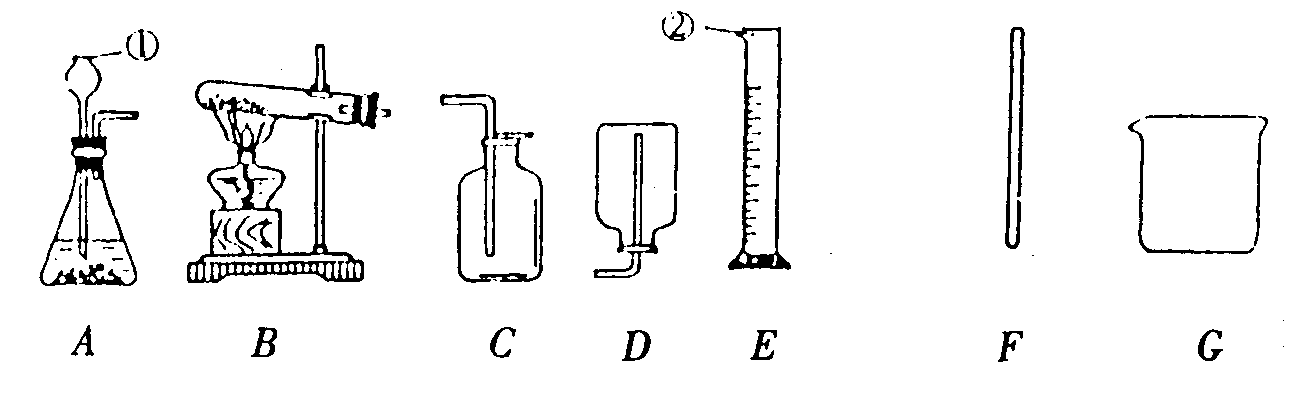
(1)写出图中①、②仪器的名称:① ,② 。
(2)为完成下列实验,请选择所需上述仪器或装置,将其编号填在横线上,并填空回答问题。
① 实验室制取并收集氧气(使用氯酸钾和二氧化锰)需用 。
② 实验室制取并收集二氧化碳需用 。证明收集装置中的二氧化碳已充满的方法是 。
③ 配制50g5%的氯化钠溶液需用 。
(3)某同学用氯酸钾和二氧化锰制取氧气,反应的化学方程式为 ,欲从完全反应后所余的固体残留物中分离得到固体氯化钾,正确的实验操作顺序是溶解、过滤、
、 。
(4)向盛有质量相等的足量的稀盐酸的两只烧杯中,分别投入铝与镁,反应结束后,发现两只烧杯中所得溶液的质量相等。则投入的铝与镁的质量之比为 (写出最简整数比)。
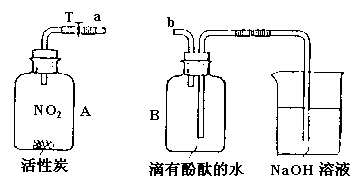
28.(2分)活性炭是一种高效的气体净化剂,能吸附有害气体![]() 。如下图装置,A中充满了红棕色的
。如下图装置,A中充满了红棕色的![]() 气体,向A中加入活性炭并充分振荡,再将
气体,向A中加入活性炭并充分振荡,再将![]() 和
和![]() 连接,打开T处弹簧夹,装置A、B中可分别观察到的现象是:
连接,打开T处弹簧夹,装置A、B中可分别观察到的现象是:
A: ;
B: 。
七.(本大题共3题 共12分)
29.(3分)根据尿素的化学式![]() 计算:
计算:
(1)尿素的相对分子质量为 。
(2)有一不纯的尿素样品,测知含氮元素44.8%,若已知杂质不含氮元素,则此化肥中有效成分尿素的质量分数为 (精确到1%)。
30.(2分)实验室要配制360.0%10%的盐酸,需要36%的浓盐酸(密度为1.18g/cm3)
mL(精确到0.1),水(密度为1g/cm3) mL。
31.(7分)将氯化钠和硫酸钠的混合物7.99g溶于22g水中,再向其中加入31.2g质量分数为20%的氯化钡溶液,恰好完全反应,过滤。求所得滤液中溶质的质量分数。(计算结果精确到0.1%)
2004�2005学年度河西区第二学期九年级第二次质量调查
化学试题参考答案及评分标准
一.(20分)每题2分。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | D | B | C | B | D | B | C | A |
二.(10分)每题2分。
| 11 | 12 | 13 | 14 | 15 |
| C | C、D | B | B、D | A、B |
三.(17分)
16.(6分)(1)⑤ (2)③ (3)② (4)① (5)④ (6)⑥(每空1分共6分)
17.(2分)+3 Y2O3(每空1分共2分)
18.(1分)3 2(每空0.5分共1分)
19.(2分)NH3 碱(每空1分共2分)
20.(2分)CO2(或二氧化碳) N2(或氮气)(每空1分共2分)
21.(4分)![]() (稀)
(稀)![]() (其他合理答案亦可)
(其他合理答案亦可)
![]() (每空2分共4分)
(每空2分共4分)
四.(16分)
22.(8分)
(1)![]()
(2)![]()
(3)![]()
(4)![]() (每个化学方程式2分共8分)
(每个化学方程式2分共8分)
23.(8分)
① ![]()
② ![]()
③ ![]()
④ ![]()
五.(12分)
24.(3分)![]() 溶液、浓硫酸
溶液、浓硫酸
![]() 溶液
溶液
![]() 溶液(每空1分共3分)
溶液(每空1分共3分)
25.(6分)
(1)![]() (其他合理答案亦可)
(其他合理答案亦可)
向滤液A中滴加![]() 溶液会出现白色沉淀(其他合理答案亦可)(每空1分共2分)
溶液会出现白色沉淀(其他合理答案亦可)(每空1分共2分)
(2)洗涤(1分)
(3)盐酸(1分)
(4)![]() (2分)
(2分)
26.(3分)
① 硝酸钡、氯化钠、碳酸钙
② 硝酸钡、氯化钠、碳酸钠
③ 硝酸钡、氯化钠、碳酸钙、碳酸钠(每空1分共3分)
六.(13分)
27.(11分)
(1)① 长颈漏斗 ② 量筒(每空1分共2分)
(2)① BC ② AC 用燃着的木条放在集气瓶口,火焰会熄灭 ③ EFG(每空1分共4分)
(3)![]() (2分)
(2分)
蒸发 结晶(每空0.5分共1分)
(4)![]() (2分)
(2分)
28.(2分)
A:红棕色褪去(或红棕色变浅) B:溶液显红色,液面升高(每空1分共2分)
七.(12分)
29.(3分)(1)60(1分) (2)96%(2分)(共3分)
30.(2分)84.7 260(每空1分共2分)
31.(7分)
解:设混合物中![]() 的质量为
的质量为![]() ,生成
,生成![]() 的质量为
的质量为![]() 。
。
![]() 的质量=
的质量=![]() (1分)
(1分)
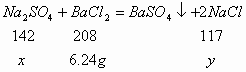
![]()
![]() (1分)
(1分)
![]()
![]() (1分)
(1分)
滤液中溶质![]() 的质量
的质量![]() (1分)
(1分)
滤液中溶剂![]() 的质量
的质量![]() (1分)
(1分)
滤液的质量![]() (1分)
(1分)
滤液中![]() 的质量分数
的质量分数![]() (1分)
(1分)
答:所得滤液中溶质的质量分数为13.4%。