和平区2004�2005学年度第二学期九年级化学模拟试卷
第I卷(选择题 共30分)
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Si:28 Cl:35.5
S:32 Ca:40 Mn:55 Fe:56 Cu:64 Ba:137
一. 选择题(本题共20分)每题只有一个正确答案,每题2分。
1. 下列变化中都能产生热,其中主要由物理变化所生成的热是( )
A. 电熨斗通电后生热
B. 大量枯枝烂叶埋在地下发酵生热
C. 生石灰遇水生热
D. 电火花点燃氢气和氧气的混合气体生热
2. 下列说法不正确的是( )
A. 乙醇的化学式为![]() ,可作燃料
,可作燃料
B. 消毒酒精中,乙醇的体积分数为85%~95%
C. 冰醋酸是纯净物,工业酒精是混合物
D. 天然气的主要成分是甲烷
3. 下列粒子结构示意图表示阴离子的是( )
A.  B.
B. 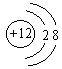 C.
C. 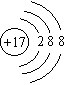 D.
D. 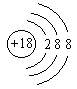
4. 下图中关于化学式(![]() )的各种意义,其中描述错误的一幅是()
)的各种意义,其中描述错误的一幅是()
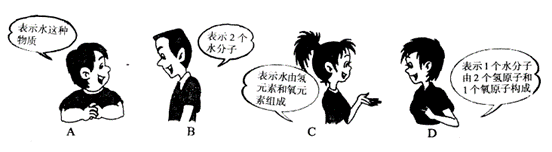
5. 铁是日常生活中接触最多、用途最广的金属之一。有关铁的说法错误的是( )
A. 我国政府正在启动的“酱油加铁”工程是为了预防缺铁性贫血
B. 铁可以在氧气中燃烧
C. 铁与盐酸反应生成氯化铁和氢气
D. 铁在潮湿的空气中会生锈
6. 已知单质A的相对分子质量为28,单质B的相对分子质量为32,A、B两种单质间存在反应:![]() ,由此可以确定化合物C的相对分子质量为()
,由此可以确定化合物C的相对分子质量为()
A. 76 B. 60 C. 152 D. 74
7. 为了增强市民的环保意识,变废为宝,去年年底某市在全国率先实行垃圾分类回收。市区街道的垃圾箱中,绿色箱用来装可回收再利用的垃圾,黄色箱用来装不可回收再利用的垃圾。以下物质能扔进绿色垃圾箱的是()
① 废旧报纸 ② 废铜丝 ③ 已浸泡过的茶叶 ④ 口香糖 ⑤ 果皮 ⑥ 空矿泉水瓶 ⑦ 废铁锅
A. ①③⑤⑦ B. ③④⑤⑥ C. ①②⑤⑦ D. ①②⑥⑦
8. 下列化学实验操作中,不正确的是( )
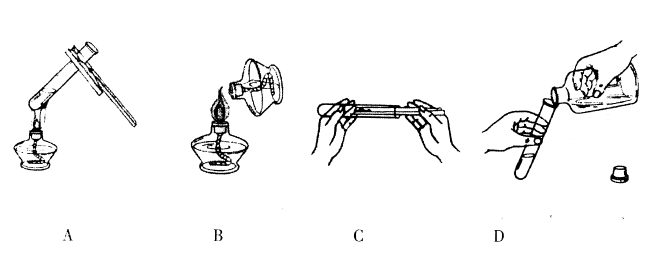
A B C D
9. 应用储能介质(某种结晶水合物)储存和再利用太阳能是一项新技术,其原理是:当白天阳光照射时,储能介质熔化,同时吸收热能;当夜晚环境降温时,储能介质凝固,同时释放出热能。某地区白天气温可达约40℃,夜晚时可下降至![]() ℃以下。根据上述原理和表中几种常见储能介质的有关数据,该地区应用上述技术调节室温时选用储能介质最好是表中的()
℃以下。根据上述原理和表中几种常见储能介质的有关数据,该地区应用上述技术调节室温时选用储能介质最好是表中的()
|
| 结晶水合物 | 熔点/℃ | 熔化时吸热( |
| A |
| 29.0 | 0.172 |
| B |
| 32.4 | 0.239 |
| C |
| 36.1 | 0.282 |
| D |
| 48.5 | 0.200 |
10. 有![]() 、
、![]() 、
、![]() 、
、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、稀硫酸等7种物质,在常温下两种物质间能发生的化学反应最多有()
溶液、稀硫酸等7种物质,在常温下两种物质间能发生的化学反应最多有()
A. 4个 B. 5个 C. 6个 D. 7个
二. 选择题(本题共10分)每题有1~2个正确答案,每题2分。正确答案只有一个选项的,多选不给分;正确答案包括两个选项的只选一个且正确给1分,一对一错不给分。
11. 下图中“�”表示相连的物质在一定的条件下可以反应,“![]() ”表示丁在一定条件下可以转化为乙。下表四组选项中符合下图要求的是()
”表示丁在一定条件下可以转化为乙。下表四组选项中符合下图要求的是()
|
| 甲 | 乙 | 丙 | 丁 |
| A |
|
|
|
|
| B |
|
|
|
|
| C |
|
|
|
|
| D |
|
|
|
|
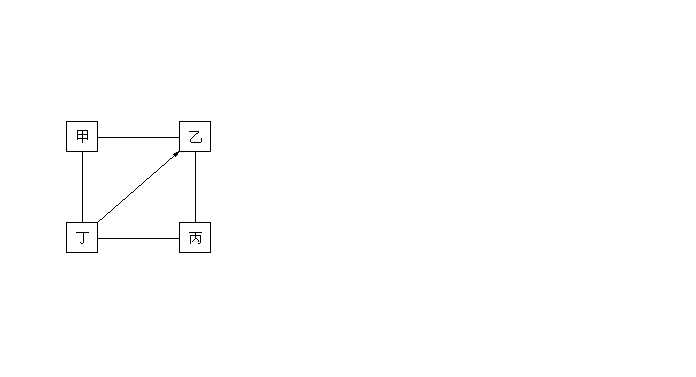
12. 下列实验方案中,你认为可行的是( )
A. 用过滤的方法分离![]() 和
和![]() 的混合物
的混合物
B. 用![]() 溶液除去
溶液除去![]() 中混有的
中混有的![]() 气体
气体
C. 向某无色溶液中滴加![]() 溶液,产生白色沉淀,证明溶液中一定含有
溶液,产生白色沉淀,证明溶液中一定含有![]()
D. 用适量![]() 溶液除去
溶液除去![]() 溶液中混有的少量
溶液中混有的少量![]()
13. 下列各组物质的溶液中,不用其他任何试剂就能鉴别出来的是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]()
B. ![]() 、
、![]() 、
、![]() 、
、![]()
C. ![]() 、
、![]() 、
、![]() 、
、![]()
D. ![]() 、
、![]() 、
、![]() 、
、![]()
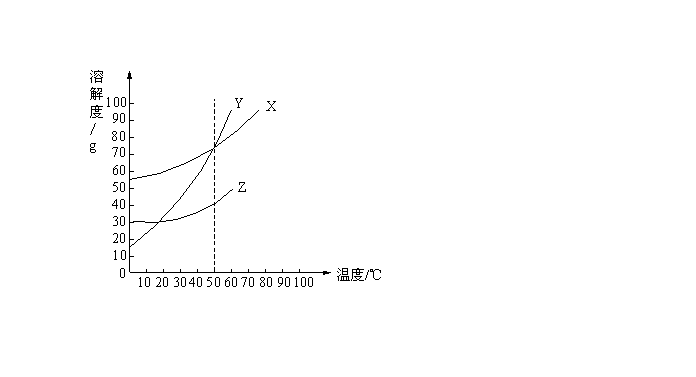
14. X、Y、Z三种固体物质的溶解度曲线如下图所示,下列说法中,不正确的是( )
A. 溶解度:![]()
B. 50℃时,X、Y的溶液中溶质的质量分数相同
C. 当Y中含有少量Z时,可将其溶解于水中制成较浓的溶液,再降温结晶提纯Y
D. X、Y、Z都属于易溶于水的物质
15. 在氯化亚铁和氯化铜的混合溶液中加入锌粉,下列说法中不正确的是( )
A. 若反应完成后锌有剩余,则溶液中有![]() ,无
,无![]() ,可能有
,可能有![]()
B. 若反应完成后锌有剩余,则溶液中有![]() ,没有
,没有![]() 和
和![]()
C. 若反应完成后锌无剩余,溶液中若有![]() ,则一定有
,则一定有![]()
D. 若反应完成后锌无剩余,溶液中若无![]() ,则一定含有
,则一定含有![]() ,可能含有
,可能含有![]()
第II卷(选择题 共70分)
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Ca:40 Ba:137
三.(本题共12分)
16.(4分)初中化学学习了氢、氧、碳、铁等元素的单质及其化合物的知识。请回答:
(1)由H、O、C、Fe组成的常见化合物中,属于酸性氧化物的是 ,属于无机含氧酸的是 ,属于碱的是 ,属于有机物的是(只写一种) (以上各空均填写化学式)。
(2)氢气作为高能燃料具有的优点是 。
① 来源丰富 ② 单位质量的氢气燃烧时发热量大 ③ 燃烧后不产生污染物
A. ①③ B. ①② C. ②③ D. ①②③
(3)我国古代用墨写的字虽年深日久仍不变色,其原因是 。
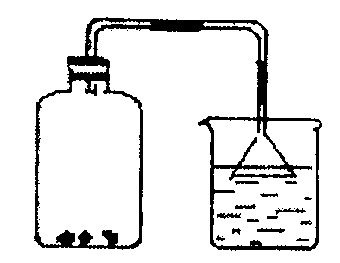
17.(2分)如图所示,向盛有红棕色二氧化氮气体的广口瓶中投入几块木炭,广口瓶里出现 现象,说明木炭具有 能力。
18.(2分)液晶是一类新型材料,广泛用于电子、仪表产品等。MBBA是一种研究较多的液晶材料,其化学式为![]() 。MBBA的相对分子质量为 ,1个MBBA分子中含有 个原子。
。MBBA的相对分子质量为 ,1个MBBA分子中含有 个原子。
19.(4分)看下面表格,请回答问题:
(表一)地壳里各种元素的含量
| 元素名称 | 质量分数 | 元素名称 | 质量分数 |
| 氧 | 48.60% | 钠 | 2.74% |
| 硅 | 26.3% | 钾 | 2.47% |
| 铝 | 7.73% | 其他 | 3.59% |
| 铁 | 3.45% |
|
|
(表二)我国渤海、黄、东、南海水中所含主要元素的总量
| 元素名称 | 元素总量/t | 元素名称 | 元素总量/t | 元素名称 | 元素总量/t |
| 氧 |
| 钾 |
| 铜 |
|
| 氢 |
| 溴 |
| 镍 |
|
| 氯 |
| 氟 |
| 铝 |
|
| 钠 |
| 磷 |
| 锰 |
|
| 镁 |
| 碘 |
| 钛 |
|
| 硫 |
| 铁 |
| 银 |
|
| 钙 |
| 锡 |
| 金 |
|
(1)“表一”与“表二”中对元素含量的表示方法 (填相同或不同),“表一”中元素的含量用 表示的。
(2)“表一”中含量最高的金属元素和含量最高的非金属元素形成化合物的化学式为
。
(3)“表一”中氢元素含量没有单独列出,说明含量较少,而“表二”中氢元素的含量却位居第二,其原因是 。
四.(本题共17分)
20.(2分)过氧乙酸(![]() )是一种广泛、高效的消毒剂,曾在“非典”时期得到广泛使用。过氧乙酸中碳、氢、氧三种元素的质量比为
;某同学需要配制2240g 0.5%的过氧乙酸溶液,需要20%的过氧乙酸
)是一种广泛、高效的消毒剂,曾在“非典”时期得到广泛使用。过氧乙酸中碳、氢、氧三种元素的质量比为
;某同学需要配制2240g 0.5%的过氧乙酸溶液,需要20%的过氧乙酸
![]() (此种过氧乙酸的密度为
(此种过氧乙酸的密度为![]() )
)
21.(9分)完成下列化学方程式,并注明基本反应类型
(1)镁条在空气中燃烧 ,其基本反应类型为 ;
(2)用高锰酸钾制氧气 ,其基本反应类型为 ;
(3)用锌和稀硫酸制氢气 ,其基本反应类型为 。
22.(3分)某学生在网上学习时获得信息:在沙漠高温灼烤下,沙粒中含有的少量的碳酸钙会发生反应:![]() ,含有这类沙粒的“沙尘暴”可使酸雨的酸性降低。请回答:
,含有这类沙粒的“沙尘暴”可使酸雨的酸性降低。请回答:
(1)“沙尘暴”中能使酸雨酸性降低的物质的化学式是 。
(2)若该酸雨的主要成分是亚硫酸,则发生反应的化学方程式为: 。
23.(3分)某气体可能由![]() 、
、![]() 、
、![]() 中的一种或几种组成。分别将它们在氧气中燃烧后,将生成物依次通过下图装置(浓硫酸用来吸收水分)。试回答:
中的一种或几种组成。分别将它们在氧气中燃烧后,将生成物依次通过下图装置(浓硫酸用来吸收水分)。试回答:
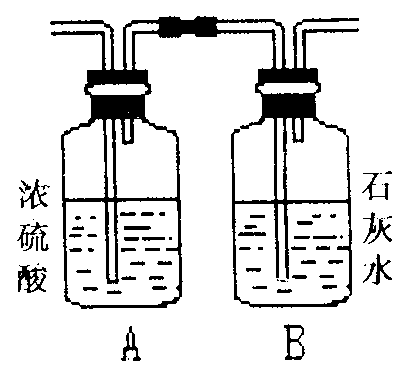
(1)若装置A的质量增加,B的质量不变,则该气体是 。
(2)若装置A的质量不变,B的质量增加,则该气体是 。
(3)若装置A、B的质量都增加,则该气体的可能组成是 。
五.(本题共15分)
24.(6分)根据下列装置图回答问题(装置图用序号填空)。
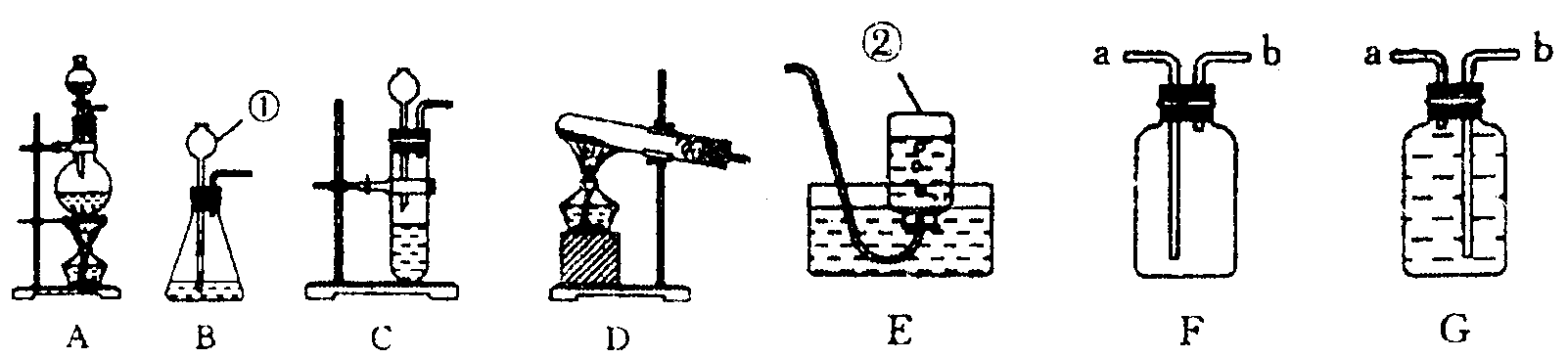
(1)写出编号①和②仪器的名称:① ②
(2)实验室用![]() 制
制![]() 时,应选用
做气体发生装置。实验室制取
时,应选用
做气体发生装置。实验室制取![]() 时,应选用
做气体发生装置。已知
时,应选用
做气体发生装置。已知![]() 固体和浓盐酸混合共热可制得氯气(
固体和浓盐酸混合共热可制得氯气(![]() ),则应选用
做气体发生装置。
),则应选用
做气体发生装置。
(3)有一名同学欲用F装置收集![]() ,则
,则![]() 应从导管口
通入。
应从导管口
通入。
25.(6分)需配制100g12%的氢氧化钠溶液,请按实验要求填写各空白处:
(1)调托盘天平的零点,若指针偏向右边,应将左边的平衡螺母向 (填“左”或“右”)移,直到指针指在 的中央。
(2)称取12g氢氧化钠,先将 放在左盘,再将氢氧化钠固体放在其中,加砝码时,先加质量 (填“大”或“小”)的砝码,再加质量 (填“大”或“小”)的砝码,直至称为12g氢氧化钠为止。
(3)溶解时,用 量取88mL水倒入盛氢氧化钠的容器中,用玻璃棒搅拌,使之溶解。
26.(3分)某食品公司通常在其生产的“××雪饼”的包装袋内放入一小包干燥剂,上面的部分见图。请仔细阅读,回答下列的问题:
这包干燥剂吸收水分时反应的化学方程式为 ;“请勿食用”是因为干燥剂吸水后具有 性。

六.(本题共18分)
27.(8分)实验室里有一瓶标签残缺的盐酸,请你来探究:
(1)怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是。你认为应该用下述中的 (填选项编号)方法立即确认。
A. 讨论 B. 调查 C. 实验 D. 上网
具体的做法是 。
(2)粗略测定每毫升该盐酸中所含溶质![]() 的质量。同学们依据酸碱中和反应的原理,设计了一种可行的方案,其操作步骤如下:
的质量。同学们依据酸碱中和反应的原理,设计了一种可行的方案,其操作步骤如下:
① 向小烧杯中加入10g 5%的![]() 溶液;
溶液;
② 向上述烧杯中滴入2滴酚酞溶液;
③ 向10mL的量筒里注入该盐酸至一定刻度;
④ 用胶头滴管吸取量筒内的盐酸,逐滴滴入上述盛放![]() 溶液的小烧杯中,直到溶液刚好变成无色时为止;
溶液的小烧杯中,直到溶液刚好变成无色时为止;
⑤ 记录实验数据;
⑥ 计算,确定每毫升盐酸中含溶质![]() 的质量。
的质量。
(3)请你根据以上实验过程,回答下列问题:
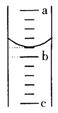
① 第3步向量筒中注入盐酸,量筒中液面的位置如图所示,![]() 与
与![]() 、
、![]() 与
与![]() 的刻度均相差
的刻度均相差![]() ,如果刻度
,如果刻度![]() 为7,量筒中盐酸的体积为
为7,量筒中盐酸的体积为 ![]() 。
。
② 第4步要到用玻璃棒,它是起 作用,目的是 ;停止滴入盐酸后,胶头滴管中残留的盐酸应 。
③ 第4步操作中指示剂(酚酞试液)颜色刚好褪色所表示的含义是什么?
答: 。
④ 第5步要记录的实验数据是 。
28.(5分)在下图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质。C为一种黑色粉末,D为一种气体。
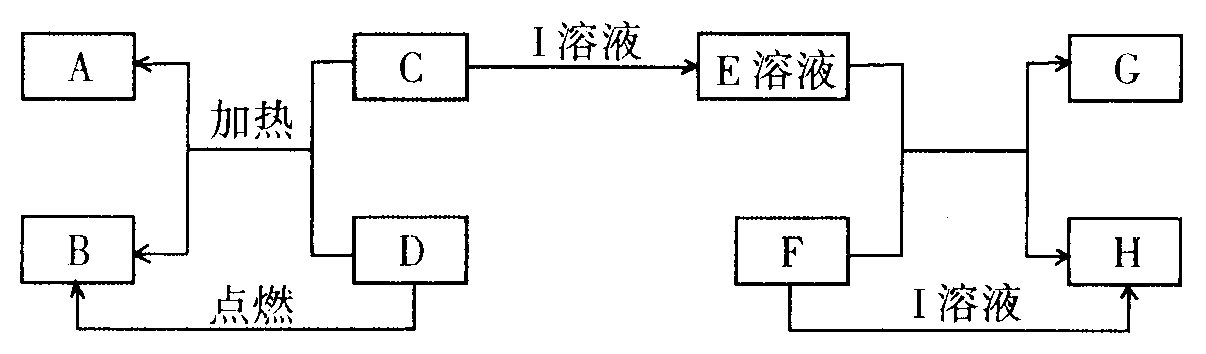
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀。则A为 ;D可能为 。
(2)若G为蓝色沉淀,H为难溶性盐,则I为 。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为 ;F可能为 。
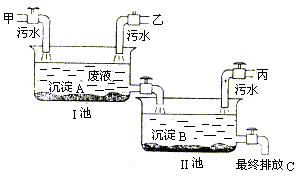
29.(5分)2003年6月5日世界环境日的主题是:“水��二十亿人生命之所系”。请你回答下列问题:
(1)自来水常用二氧化氯(![]() )来杀菌消毒,它能转化为可溶解性氯化物。为检验自来水中是否含有氯离子,应选用的化学试剂是
。
)来杀菌消毒,它能转化为可溶解性氯化物。为检验自来水中是否含有氯离子,应选用的化学试剂是
。
(2)节约用水,防治水污染具有十分重要的意义。某工厂有甲、乙、丙三个车间,各自排放的污水中均无沉淀物。各车间的污水分别含有以下六种物质中的各两种:KOH、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。为防止污染水源,某中学化学兴趣小组配合工厂进行污水检测,结果如下表。
。为防止污染水源,某中学化学兴趣小组配合工厂进行污水检测,结果如下表。
| 试剂 现象 车间 | 石蕊试液 | 氯化钡溶液 |
| 甲 | 蓝色 | 白色沉淀 |
| 乙 | 紫色 | 无明显现象 |
| 丙 | 红色 | 白色沉淀 |
可确定丙车间排放的污水中含有 和 。为变害为利,化学兴趣小组与工厂研究设计如下图污水处理方案。请回答:沉淀A是 ,若各步处理均完全反应,最终排放液C的溶质是 ,在农业上它可用作复合肥料。
七.(本题共8分)
30.(3分)人体缺钙易产生“骨质疏松症”。一体重为60kg的缺钙病人每天除从食物中获得钙质外,还需从药物中补钙质0.5g。若医生确定此人每天至少吃“盖中盖”钙片6.25g,且知“盖中盖”钙片中的有效成分为葡萄糖酸钙![]() 。试求:
。试求:
(1)葡萄糖酸钙的相对分子质量 。
(2)葡萄糖酸钙中钙元素的质量分数 。(精确到1%)
(3)该钙片中葡萄糖钙的质量分数 。(精确到1%)
31.(5分)将11g含有少量氯化钠杂质的纯碱样品溶于50g水中。向该溶液中加入79.7g氯化钡溶液恰好完全反应,生成沉淀19.7g。
计算:
(1)纯碱样品中氯化钠的质量分数;
(2)反应后的溶液中溶质的质量分数。(如果计算结果除不尽保留一位小数)
和平区2004�2005学年度第二学期九年级化学模拟试卷标准答案与评分标准
一. 选择题(本题共20分)每题只有一个正确答案,每题2分。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | B | C | B | C | A | D | B | C | C |
二. 选择题(本题共10分)每题有1�2个正确答案,每题2分。正确答案只有一个选项的,多选不给分;正确答案包括两个选项的只选一个且正确给1分,一对一错不给分。
| 题号 | 11 | 12 | 13 | 14 | 15 |
| 答案 | C | D | CD | AB | A |
三.(本题共12分)
16.(共4分)
(1)CO2;(0.5分)H2CO3(0.5分)![]() [或
[或![]() ];(0.5分)
];(0.5分)![]() (或
(或![]() 、
、![]() 、
、![]() )(0.5分)
)(0.5分)
(2)D(1分)
(3)在常温下,碳的化学性质很稳定(1分)
17.(共2分)红棕色消失(或变浅);(1分)吸附(1分)
18.(共2分)267(1分);41(1分)
19.(共4分)(1)不同;(1分)质量分数;(1分)(2)![]() (1分)
(1分)
(3)海水中水是主要成分,水是由氢元素和氧元素组成,氢元素在水中的质量分数排在第二位。(1分)
四.(本题共17分)
20.(共2分)![]() (1分);50(1分)
(1分);50(1分)
21.(共9分)
(1)![]() (2分)化合反应(1分)
(2分)化合反应(1分)
(2)![]() (2分)分解反应(1分)
(2分)分解反应(1分)
(3)![]() (稀)
(稀)![]() (2分)置换反应(1分)
(2分)置换反应(1分)
22.(共3分)(1)![]() (1分) (2)
(1分) (2)![]() (2分)
(2分)
23.(共3分)(1)H2(1分)(2)CO(1分)
(3)H2和CH4(1分)(或H2、CO;CH4和CO;H2、CH4和CO,答对一组即可给分)
五.(本题共15分)
24.(共6分)
(1)① 长颈漏斗(1分) ② 集气瓶(1分)
(2)D(1分);B(1分)A(1分)
(3)b(1分)
25.(共6分)
(1)左边(1分);分度盘(1分)
(2)烧杯(或玻璃器皿);(1分)大;(1分)小(1分)
(3)量筒(多答胶头滴管不扣分)(1分)
26.(共3分)![]() ;(2分)腐蚀性(1分)
;(2分)腐蚀性(1分)
六.(本题共18分)
27.(共8分)
(1)C(1分);打开瓶塞,若瓶口有白雾冒出即为浓盐酸,否则不是浓盐酸。(1分)
(2)① 6.2;(1分)
② 搅拌;(1分)让反应物混合均匀,充分反应;(1分)全部滴入量筒中;(1分)
③ 指示![]() 与
与![]() 此时恰好反应(中和);(1分)
此时恰好反应(中和);(1分)
④ 量筒中剩余盐酸的体积(或中和![]() 用去的盐酸体积)(1分)
用去的盐酸体积)(1分)
28.(共5分)
(1)Cu(1分) CO(或H2)(1分)
(2)H2SO4(1分)
(3)HCl[或![]() ](1分)
](1分)![]() [或
[或![]() 或
或![]() ](1分)(答案必须一一对应)(只要符合题意,答案合理正确,写对一组就给分)
](1分)(答案必须一一对应)(只要符合题意,答案合理正确,写对一组就给分)
29.(共5分)
(1)![]() 和稀硝酸(1分)(不答稀硝酸也给分)
和稀硝酸(1分)(不答稀硝酸也给分)
(2)![]() ;(1分)
;(1分)![]() ;(1分)
;(1分)![]() ;(1分)
;(1分)![]() (1分)
(1分)
七.(本题共8分)
30.(共3分)
(1)430(1分) (2)9%(1分) (3)89%(1分)
31.(共5分)
解:设:![]() 的质量为
的质量为![]() ,生成
,生成![]() 的质量为
的质量为![]()
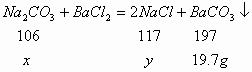
![]() (1分)
(1分)
![]() (1分)
(1分)
(1)纯碱样品中氯化钠的质量分数![]() (1分)
(1分)
(2)反应后溶液的质量![]() (1分)
(1分)
溶液中溶质的质量分数![]() (1分)
(1分)
(如果第二问只列一个综合式全对为2分,只要有错扣2分)
溶液中溶质的质量分数![]()
(其它算法,只要符合题意,结果正确均可得分)
答:纯碱样品中氯化钠的质量分数为3.6%,生成物溶液中溶质的质量分数为10%。