《酸和碱》知识点
一、酸、碱、盐的组成
![]() 酸是由氢元素和酸根组成的化合物 如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
酸是由氢元素和酸根组成的化合物 如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)
盐是由金属元素元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)
二、酸
1、浓盐酸、浓硫酸的物理性质、特性、用途
|
| 浓盐酸 | 浓硫酸 |
| 颜色、状态 | “纯净”:无色液体 工业用盐酸:黄色(含Fe3+) | 无色粘稠、油状液体 |
| 气味 | 有刺激性气味 | 无 |
| 特性 | 挥发性 (敞口置于空气中,瓶口有白雾) | 吸水性 脱水性 强氧化性 腐蚀性 |
| 用途 | ①金属除锈 ②制造药物 ③人体中含有少量盐酸,助消化 | ①金属除锈 ②浓硫酸作干燥剂 ③生产化肥、精炼石油 |
2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)
(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属 + 酸 → 盐 + 氢气
(3)碱性氧化物 + 酸 → 盐 + 水
(4)碱 + 酸 → 盐 + 水
(5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件)
3、三种离子的检验
| 试剂 | |
| Cl- | AgNO3 及HNO3 |
| SO42- | ①Ba(NO3)2及HNO3②HCl 及BaCl2 |
| CO32- | HCl 及石灰水 |
三、碱
1、氢氧化钠、氢氧化钙的物理性质、用途
|
| 氢氧化钠 | 氢氧化钙 |
| 颜色、状态 | 白色固体,极易溶于水(溶解放热) | 白色粉末,微溶于水 |
| 俗名 | 烧碱、火碱、苛性钠(具有强腐蚀性) | 熟石灰、消石灰 |
| 制法 | Ca(OH)2+Na2CO3== CaCO3↓+2NaOH | CaO +H2O== Ca(OH)2 |
| 用途 | ①氢氧化钠固体作干燥剂 ②化工原料:制肥皂、造纸 ③去除油污:炉具清洁剂中含氢氧化钠 | ①工业:制漂白粉 ②农业:改良酸性土壤、配波尔多液 ③建筑: |
2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)
(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色
(2)酸性氧化物+碱 → 盐+水
(3)酸+碱 → 盐+水
(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)
注:①难溶性碱受热易分解(不属于碱的通性)
如Cu(OH)2 ΔCuO +H2O
2Fe(OH)3 ΔFe2O3+3H2O
②常见沉淀:AgCl↓ BaSO4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓ BaCO3↓ CaCO3↓
③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
五、酸性氧化物与碱性氧化物
| 酸性氧化物 | 碱性氧化物 | |
| 定 义 | 凡能与碱反应生成盐和水的氧化物 大多数非金属氧化物是酸性氧化物 大多数酸性氧化物是非金属氧化物 | 凡能与酸反应生成盐和水的氧化物 大多数金属氧化物是碱性氧化物 所有碱性氧化物是金属氧化物 |
| 化 学 性 质 | (1)大多数可与水反应生成酸 CO2+H2O== H2CO3 SO2+H2O== H2SO3 SO3+H2O== H2SO4 | (1)少数可与水反应生成碱 Na2O +H2O== 2NaOH K2O +H2O== 2KOH BaO +H2O== Ba(OH)2 CaO +H2O== Ca(OH)2 |
| (2) 酸性氧化物+碱 → 盐+水 CO2 +Ca(OH)2== CaCO3↓+H2O (不是复分解反应) | (2) 碱性氧化物+酸 → 盐+水 Fe2O3+6HCl== 2FeCl3+3H2O |
四、中和反应 溶液酸碱度的表示法——pH
1、定义:酸与碱作用生成盐和水的反应
2、应用:
(1)改变土壤的酸碱性
(2)处理工厂的废水
(3)用于医药
3、溶液酸碱度的表示法——pH
(1)0 7 14
![]()
酸性增强 中性 碱性增强
(2)pH的测定:最简单的方法是使用pH试纸
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)
(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)
pH<5.6的雨水为酸雨
《酸和碱》复习练习
1、下列各组中的化学式、俗名与化学名称均一致的是 ( )
A、CaO 熟石灰 氧化钙 B、Ca(OH)2 生石灰 氢氧化钙
C、HCl 盐酸 氢氯酸 D、NaOH 纯碱 氢氧化钠
2、下列有关说法,不是稀硫酸和两者共有的是 ( )
A、实验室制取氢气 B、金属表面除锈
C、敞口放置在空气中,溶质的质量分数会变小 D、清洗水壶中的水垢
3、实验室里鉴别稀硫酸和盐酸,可以选用的试剂是 ( )
A、 氧化铜 B、 氢氧化钡 C、 氯化钡 D、 硝酸银
4、下列四种反应类型的化学反应中,反应物和生成物中均不可能存在单质的是 ( )
A、分解反应 B、 化合反应 C、 置换反应 D、复分解反应
5、能将Ba(OH)2、NaCl、K2CO3三种无色溶液区分开来的是 ( )
A、硝酸 B、硫酸 C、硝酸银 D、石蕊试液
6、“雪碧”等碳酸饮料的pH小于7,晃动后打开瓶盖,其pH将 ( )
A、变大 B、变小 C、不变 D、无法判断
7、下列各组内的离子,在溶液中不能大量共存的是 ( )
A、H+ SO42- Ba2+ NO3- B、Ca2+ H+ NO3- Cl-
C、Mg2+ K+ NO3- Cl- D、K+ Na+ Mg2+ SO42-
8、将下列各组物质分别同时加入到水中,得到无色透明溶液的是 ( )
A、CuSO4 Na2SO4 NaOH B、K2SO4 Ba(OH)2 HNO3
C、KOH MgSO4 KNO3 D、KCl K2SO4 KNO3
9、下列各组溶液中,不加任何其他试剂,就能鉴别的一组是 ( )
A、CuSO4 HCl NaOH B、KOH HCl NaCl
C、H2SO4 CuSO4 HCl D、KOH MgSO4 KNO3
10、下列物质中可以导电的是 ( )
A、NaCl溶液 B、NaCl固体 C、熔融的NaCl D、蔗糖溶液
11、用100克9.8%的硫酸溶液恰好中和一定量的氢氧化钠溶液,如果改用等质量、等质量分数的稀盐酸,再滴入紫色石蕊试液,溶液显 ( )
A、紫色 B、蓝色 C、红色 D、无色
![]() 12、写出下列变化的化学方程式:
12、写出下列变化的化学方程式:
Cu CuO CuCl2 Cu(OH)2 CuO Cu
(1)____________________________________(2)
(3) (4)
(5)
13、选择合适的试剂除去括号内的杂质,写出化学方程式
(1)FeCl2(CuCl2)
(2)KCl(CuCl2)
(3)NaNO3〔Fe2(SO4)3〕
(4)CO2(O2)
14、A、B等物质在溶液中存在如下三个转换关系:
(1)A + FeCl3 → B↓(红褐色)+ C
(2)C + D → E↓(白色)+ F
(3)F + AgNO3 → G↓(白色)+ HNO3
完成C跟D溶液反应的化学方程式:
写出白色沉淀G的化学式 ;写出A溶液中溶质的化学式 。
15、A为无色溶液,能使无色酚酞变为红色,取少量A做如下实验:
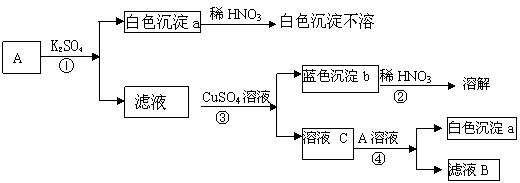
根据实验推断下列物质的名称:A是 ,B是 ,C是
写出①②③④反应的化学方程式:
① ②
③ ④
16、复分解反应是我们学过的化学基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式。
①氯化钡溶液与硫酸溶液混合: ;
②碳酸钾溶液与稀盐酸混合: ;
③氢氧化钡溶液与稀硝酸混合: 。
(2)你想过上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。如上述反应①中,实际参加反应的离子是Ba2+ 和SO42-,而Cl-、H+ 则是“旁观者”,并没有参加反应。请你分析上述反应②中实际参加反应的离子是 ;上述反应③中实际参加反应的离子是 。
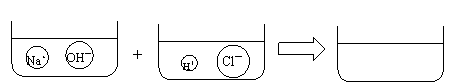
(3)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图。