第四单元 物质构成的奥秘复习学案
1、原子的构成
(1)原子结构示意图的认识
 |  | ||||||||||
| |||||||||||
| |||||||||||
![]() (2)在原子中核电荷数=质子数=核外电子数
决定元素种类 质子数(核电荷数)
(2)在原子中核电荷数=质子数=核外电子数
决定元素种类 质子数(核电荷数)
(3)原子的质量主要集中在 原子核 上 (4)三决定 决定元素化学性质 最外层电子数
(4)相对原子质量≈质子数+中子数 决定原子的质量 原子核
说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)
最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
2、元素
(1)定义:具有相同核电荷数(质子数)的一类原子的总称
*一种元素与另一种元素的本质区别:质子数不同
注意:
*由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
(2)表示方法——元素符号——拉丁文名称的第一个字母大写
a、书写方法:
| |||||
| |||||
|
|
注意:*有些元素符号还可表示一种单质 如Fe、He 、C 、Si
*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3个氧原子
c、有关元素周期表
*发 现:门捷列夫
|
|
|
|
注:原子序数=质子数

d、分类
e、元素之最:
3、离子:带电的原子或原子团
(1)表示方法及意义:如Fe3+ :铁离子带3个单位正电荷
|
(2)离子结构示意图的认识
注意:与原子示意图的区别:质子数=电子数则为原子结构示意图

![]()
*原子数≠电子数为离子结构示意图
(3)与原子的区别与联系
| 粒子的种类 | 原 子 | 离 子 | ||
| 阳离子 | 阴离子 | |||
| 区 别 | 粒子结构 | 质子数=电子数 | 质子数>电子数 | 质子数<电子数 |
| 粒子电性 | 不显电性 | 显正电性 | 显负电性 | |
| 符 号 | 用元素符号表示 | 用阳离子符号表示 | 用阴离子符号表示 | |
二、物质的组成的表示:
1、化合价
a、写法及意义: Mg:镁元素化合价为+2价 MgCl2:氯化镁中镁元素化合价为+2价
b、几种数字的含义
Fe2+ 每个亚铁离子带两个单位正电荷 3 Fe2+:3个亚铁离子
2H2O 两个水分子, 每个水分子含有2个氢原子
c、化合物中各元素正、负化合价的代数和为零
d、化合价是元素的原子在形成化合物时表现出来的性质,所以单质分子中元素化合价为0
2、化学式
(1)写法:
a单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气、氯气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2、Cl2 。
b化合物:正价在前,负价在后(NH3,CH4除外)
(2)意义:如化学式H2O的意义:4点 化学式 Fe的意义:3点
(3)计算:
a、计算相对分子质量=各元素的相对原子质量×原子个数之和
b、计算物质组成元素的质量比:相对原子质量×原子个数之比
c、计算物质中某元素的质量分数
第四单元《物质构成的奥秘》复习检测
1、下列符号中,既能表示某种元素及该元素的一个原子,还能表示某种物质的是 ( )
A、H B、Al C、Fe3+ D、N2
2、下列对于N2、N2O、N2O3、N2O5的四种说法中,正确的是 ( )
A、都含有氮分子 B、含氮元素的质量分数都相同
C、每个分子所含氮原子数都相同 D、所含元素种类都相同
3、《中学生守则》明确规定,中学生不能吸烟。其原因之一是香烟燃烧时放出多种有毒物质和致癌物质,其中元素间的质量比3:4的物质是 ( )
A、NO B、NO2 C、SO2 D、CO
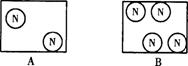
4.下列方框中,符合2N2意义的示意图是 ( )

5、H2O与H2O2的化学性质不同的原因是 ( )
A、它们的元素组成不同 B、它们在常温下状态不同
C、它们的分子构成不同 D、H2O2有氧气而H2O中没有
6、某正二价金属元素的氧化物中,金属元素与氧元素的质量比5:2,则该金属元素的相对原子质量为 ( )
A、40 B、56 C、62 D、80
7、元素X的原子最外层有3个电子,元素Y的原子最外层有6个电子,则这两种元素组成的化合物的化学式可能是 ( )
A、XY3 B、X2Y C、X2Y3 D、X3Y2
8、质子数相同的两种不同粒子可能是①同一元素的原子或离子②两个不同的分子③一种原子和一种分子④两种不同的离子⑤一种离子和一种分子 ( )
A、①③ B、①②③④ C、①③④⑤ D、①②③④⑤
9、X2+的离子核外有28有电子,其相对原子质量为65,X原子核内中子数与质子数之差为( )
A、9 B、5 C、2 D、0
10、元素的原子最外层电子得到或失去后,一定不会改变的是 ( )
①元素种类②化学性质③相对原子质量④微粒电性⑤原子核⑥电子层数⑦最外层电子数⑧核外电子总数
A、②③⑤ B、②④⑥⑧ C、②⑤ D、①③⑤
11、某硝酸铵(NH4NO3)样品(杂质不含氮)中氮元素的质量分数为28%,则其中硝酸铵的质量分数是 ( )
A、20% B、70% C、80% D、无法计算
12、标出下列带线元素的化合价
NH4NO3 MnO4-- KClO3 Cl2 NH3
13、用化学符号表示
硫离子 2个氮分子 +2价的锌元素 4个亚铁离子
2个磷酸根离子 氧化铁中铁元素的化合价为+3价
2H2CO3 (写出两个“2”的含义)
![]()
![]()
![]() 氯离子的结构示意图
氯离子的结构示意图
14、根据名称写出下列物质的化学式
氧化钠 氯化钡 硫酸铝
硫化氢 碳酸钠 硝酸铵
15、在分子、原子、质子、中子、电子、原子核、离子中
(1)构成物质的微粒 (2)构成原子核的微粒
(3)带正电的是 (4)带负电的是
(5)不带电的是 (6)决定原子质量大小的是
(7)参加化学反应时,一定发生变化的有
16、某粒子结构示意图为
(1)X表示 ,该粒子有 个电子层,Y与粒子的 关系非常密切。
(2)当X-Y=10,该粒子内为 (填类别)
(3)当Y=8时该粒子带有2个单位的负电荷,该粒子的符号为
(4)当Y=1的中性原子与Y=7的中性原子化合时,形成的化合物属于 化合物。
17、计算题:
烟草中含有对健康危害(尼古丁),其化学式为C10H14N2,试计算:
(1)尼古丁由 种元素组成,1个尼古丁分子由 个原子构成
(2)尼古丁的相对分子质量
(3)尼古丁中各元素的质量比
(4)尼古丁中氮元素的质量分数
(5)与8.1克尼古丁所含氮元素相等CO(NH2)2的质量是多少?