初二自然科学第一阶段效果评估题
相对原子质量:Fe—56 O—16 S—32 C—12 H—1 Cu—64 N—14 Cl—35.5
一、选择题(每小题2分,共60分)
1.下面关于氧气的物理性质的叙述中,错误的是 ( )
A. 氧气是没有颜色,没有气味的气体 B.液态氧是没有颜色的
C.氧气不易溶解于水 D.氧气的密度大于空气的密度
2.下列气体中,有刺激性气味的是 ( )
A.空气 B.二氧化硫 C.氧气 D.二氧化碳
3.取用较大块状的固体药品应用 ( )
A.药匙 B.镊子 C.纸槽 D.手
4.下列各种生产生活中,跟氧气的用途无关的是 ( )
A.炼钢 B.登山 C.气焊 D.充灌气球
5.下列可以直接加热的玻璃仪器是 ( )
A.烧杯 B.试管 C.蒸发皿 D.集气瓶
6.下列过程中,不包括缓慢氧化的是( )
A.钢铁生锈 B.呼吸作用 C.白磷自燃 D.碳酸钙加热分解
7.下列物质中属于纯净物的是 ( )
A.空气 B.海水 C.冰和水混合 D.澄清的石灰水
8.催化剂的作用是 ( )
A.加快反应速度 B.减慢反应速度 C.改变反应速率 D.增加生成物的量
9.一辆客车夜晚行驶在公路上,发现油箱泄漏,车厢里充满了汽油的气味,这时应该采取的应急措施是( )
A.洒水降温溶解汽油蒸气 B.打开所有的车窗,严禁一切烟火,疏散乘客
C.让车内的乘客集中到车厢后部 D.开灯查找漏油部位
10.实验室制取氧气大致可分为以下几个步骤:①点燃酒精灯,加热试管;②检查装置的气密性;③将高锰酸钾装入试管,管口放一小团棉花,塞上带导管的单孔塞,固定在铁架台上;④用排水法收集氧气;⑤熄灭酒精灯;⑥将导管从水中取出。正确的操作顺序是( )
A.②③①④⑥⑤ B.②①④⑥⑤③ C.②③①④⑤⑥ D.③④①②⑤⑥
11.确定元素种类的微粒是 ( )
A.核外电子数 B.质子数 C.中子数 D.原子核
12.下列单质的分子式,错误的是 ( )
A.氧气O2 B.木炭C C.铁Fe D.氮气N
13.下列化合物中,铁的质量分数最高的是 ( )
A.FeO B.Fe3O4 C. Fe2O3 D.FeS
14.随着人们物质生活水平的提高,人们越来越讲究生活质量。校园环境也有了较大的改善,垂柳飘飘,绿树葱葱,花儿片片。坐在教室里不时传来阵阵花香。花香这种现象说明了( )
A.分子很大 B.分子分裂成原子 C.分子在不断运动 D.分子之间有间隔
15.市售的“AD钙奶饮料”标签上标有“每100ml产品中含功效成分:钙40μg~100μg,维生素A30μg~100μg,维生素D1μg~4μg,蛋白质>1.0g”。这里钙是指( )
A.钙元素 B.钙分子 C.钙原子 D.钙单质
16.给试管里的液态物质加热,不正确的操作是( )
A.使用试管夹夹持试管 B.将需加热部分放在酒精灯外焰
C.试管口向上倾斜 D.试管口对着他人或自己
17.100毫升酒精和100毫升水混合后的总体积小于200毫升,这主要是由于( )
A.分子变小 B.分子不断地运动 C.分子分解成原子 D.分子间有间隔
18.能保持氢气化学性质的微粒是( )
A.氢分子 B.氢原子 C.氢元素 D.以上都不是
19.用向上排空气集气法收集氧气时,验证氧气瓶里氧气已收集满的方法是( )
A.用燃着的木条伸入集气瓶里 B.用燃着的木条接近集气瓶口
C.用带火星的木条接近集气瓶口 D.用带火星的木条伸入集气瓶里
20.以下灭火的方法正确的是( )
(1)降低燃烧物的着火点、温度 (2)使燃烧物隔绝空气
(3)降低燃烧物的温度到着火点以下
A.(1) B.(2) C.(1)、(2) D.(2)、(3)
21.铁原子的原子核内有26个质子和30个中子,则该原子的核外电子数为( )
A.56 B.30 C.28 D.26
22.根据质量守恒定律,铁丝在氧气中燃烧后,生成物的质量( )
A.等于铁丝的质量 B.大于铁丝的质量 C.小于铁丝的质量 D.无法比较
23.西班牙的瑞奥汀托河是一条酸河。经调查发现是由于上游河床含有的某种物质R在水中氧的作用下发生反应所致,其反应的化学方程式为:2R+2H2O+7O2===2FeSO4+2H2SO4,则R的分子式是( )
A.FeS B.Fe2SO4 C.FeO D.FeS2
24.在反应2XY+Y2===2Z中,Z的化学式为( )
A.XY B.X2Y C.XY2 D.XY3
|
|
|
③2Na2O2+2CO2===2Na2CO3+O2 ④4HNO3===2H2O+4NO2↑+O2↑
根据已学知识推断,其中最适合于潜水艇里供呼吸所用的是( )
A.① B.①② C.③ D.①②③④
26.最近科学家确认,存在着一种具有空心、且类似于足球结构的分子N60,这一发现将开辟世界能源的新领域,它可能成为一种最好的火箭燃料。下列关于N60的说法正确的是( )
A.N60是一种化合物 B.N60的相对分子质量是840克
C.N60分子属于单质 D.N60这种物质是由氮原子构成的
27.地壳里所含元素最多的是 ( )
A.氧 B.铝 C.硅 D.铁
28.下列化合物中,氮元素显-3价的是 ( )。
A.N2O B.NO2 C.NH3 D.N2O5
29.除去密闭在集气瓶中空气里的氧气,且不准其他气体混入空气中,那么在集气瓶中燃烧的物质应选用 ( )
A. 磷 B.硫 C.木炭 D.蜡烛
30.下列实验操作正确的是 ( )
A.用手拿无毒的药品 B.倾倒液体药品时,标签向着手心
C.用嘴吹灭酒精灯的火焰 D.在直立的试管中投入块状药品
二、填空题(每空1分,其中化学方程式2分一个,共32分)
31.要检查配有烧瓶的实验装置是否漏气,首先应将装置连接好,把导气管口的一端浸入_____里,用_______紧贴烧瓶外壁,发现导管口有______冒出;把手移开,一会儿,导管里形成一段___________,则可判断该装置不漏气。
32.用符号表示①2个氢原子___________ ② 氧元素 _________ ③ 3个水分子_________
33.市售“脑黄金(DHA)”的主要成分为一种不饱和脂肪酸。其分子式为C25H50COOH,它是由___________种元素组成,每个分子中含有________个原子。
34.下列6种物质:⑴O2 ⑵MnO2 ⑶H2SO4 ⑷KClO3 ⑸N2 ⑹CuO,其中属于单质的是_______________,属于化合物的是__________________,属于氧化物的是___________。
35.煤气是一种“让人欢喜让人忧”的物质。它是一氧化碳的俗称,是一种没有颜色没有气味且难溶于水的气体。让人欢喜的是一氧化碳可以燃烧并且放出大量的热,为人类提供大量热能。让人忧的是如果人们在使用煤气时不小心,可能会造成如下两大严重后果:一是如果煤气泄漏后遇到明火或电源,极易引燃一氧化碳而发生强烈爆炸;二是如果煤气泄漏后不能及时发现,将会使人中毒甚至死亡。请你阅读上面这段文章回答下列问题:
(1)一氧化碳的物理性质主要有:_____________________________
(2)一氧化碳的化学性质主要有:_____________________________
|
37.在A、B、C三支试管中,分别加入相同质量的氯酸钾,然后在B中加入少量KMnO4,在C试管中加入少量MnO2,分别加热后产生氧气最快最多的试管是 。
38.在A+B=C+D的化学反应中,8克A物质跟4克B物质恰好完全反应,生成7克C物质和_________克D物质。
39.书写化学方程式要注意的两个原则:一是遵守客观事实,二是遵守_________________。请你写出下列化学方程式,并注明分明属于哪一种反应类型。
木炭在氧气中燃烧__________________________________ 属于__________反应
碳酸氢铵(NH4HCO3)受热分解,生成氨气(NH3)、二氧化碳和水_________________________________________ 属于_____________反应
|
|
⑵H2+ Fe2O3=== Fe+ H2O
41.有下列几种含氯的化合物,①Cl2 ②HClO2 ③HClO ④HClO3 ⑤HCl,氯元素的化合价从高到低的排列顺序是(用序号)______________________________________。
三、实验题(每空1分,共10分)
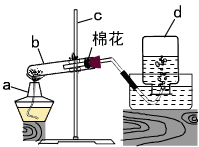 42.右图为某学生用高锰酸钾来制取氧气,并用排水法收集的装置图。
42.右图为某学生用高锰酸钾来制取氧气,并用排水法收集的装置图。
请回答下列问题:
⑴写出仪器名称:
a_____________, b______________ ,c_____________, d____________。
⑵请指出图中三处明显的错误:
________________________________________________
_______________________________________________
____________________________________________________
⑶当导管口开始有气泡冒出时,不宜立即收集,其原因是__________________________
⑷如果用高锰酸钾制氧气,应试管口内放一个棉花团,目的是为了防止加热时__________________________进入导气管。
⑸在工业上是利用液态氮和液态氧的___________不同,采用分离空气的方法制得氧气的。
四、分析计算题(共18分)
43.计算下列分子式的相对分子质量
(1)氧化铜(CuO)_____ (2)二氧化硫(SO2)_____ (3)硝酸(HNO3)___
44.氨气(NH3)是一种无色有刺激性气味的气体,极易溶于水,它的水溶液称为氨水,显碱性。氨在化学工业中用途非常广泛,例如制化肥、制纯碱等。近年来,氨还用于环境治理。
(1)氨分子中,氮、氢元素的质量之比是 。
(2)“侯氏制碱法”关键一步的反应原理可表示为:NH3+CO2+H2O+NaCl====NaHCO3+NH4Cl,其生成物NH4Cl也可作化肥,NH4Cl中氮元素的质量分数是 。
|
45.根据分子式Fe2O3计算:
(1)铁元素和氧元素的质量比。
(2)50千克的Fe2O3中含铁多少千克?
(3)要得到50千克的铁最少需要多少千克的Fe2O3?
答卷纸
一、选择题(每小题2分,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
二、填空题(每空1分,其中化学方程式2分一个,共32分)
31、 、 、 、
32、 、 、
33、 、
34、 、 、
35、 、
36、 、 、
37、
38、
39、
__________________________________ (2分) __________
_________________________________________(2分) ____________
40、
|
|
⑵H2+ Fe2O3=== Fe+ H2O
41、 (2分)
三、实验题(每空1分,共10分)
42、⑴ 、 、 、
⑵ 、
、
⑶ 、⑷ 、⑸ 、
四、分析计算题(每小题2分,共18分)
43、⑴ 、⑵ 、 ⑶
参考答案
一、选择题(每小题2分,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | B | B | D | B | D | C | C | B | A | B | D | A | C | A |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| D | D | A | C | D | D | B | D | C | C | C | A | C | A | B |
二、填空题(每空1分,其中化学方程式2分一个,共32分)
31、 水 、 手心 、气泡 、水柱
32、2H 、 O 、 3H2O
33、 3 、 79
34、 ⑴⑸ 、⑵⑶⑷⑹ 、 ⑵⑹
35、没有颜色没有气味且难溶于水、 可以燃烧并且放出大量的热
36、3个FeCl3分子、 铁元素的化合价为+3价、 每个FeCl3分子含有3个氯原子
37、 B
38、 5
|
|
NH4HCO3====NH3↑+CO2↑+H2O(2分) ________分解____
40、
|
|
⑵ 3H2+ Fe2O3=== 2 Fe+ 3 H2O
41、 ④②③①⑤ (2分)
三、实验题(每空1分,共10分)
42、⑴ 酒精灯 、 试管 、 铁架台 、 集气瓶
⑵ 试管没有略向下倾斜 、
没有用外焰加热 、
试管里的导管伸进太长
⑶ 氧气不纯 、⑷ 高锰酸钾粉末 、⑸ 沸点 、
四、分析计算题(每小题2分,共18分)
43、⑴ 80 、⑵ 64 、 ⑶ 63
44、⑴14∶3 ⑵26.2% ⑶O2
45、⑴铁元素的质量∶氧元素的质量=112∶48=7∶3
⑵50千克×=50千克×=35千克
⑶设设需要x千克的Fe2O3
x千克×=50千克
x=71.4千克