2006年通州市初三化学期末试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷总分100分。答卷时间100分钟。
可能用到的相对原子质量:H-1 C-12 N—14 O-16 Na-23 Mg-24 Al—27 S—32 Cl—35.5 K—39 Ca-40 Fe –56 Zn –65
| 题 号 | 一 | 二 | 三 | 四 | 五 | 六 | 总 分 | 结分人 | 核分人 |
| 得 分 |
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.下列涉及的内容一般不属于化学研究范围的是( )
A.研究一种新材料的用途和制备 B.研究一种新物质的组成和结构
C.研制一种新的医疗药品的性质 D.探究宏观物体的运动和规律
2.下列食品、调味品的制作过程中,没有发生化学变化的是( )
A.鲜奶制酸奶 B.糯米酿甜酒
C.水果榨果汁 D.黄豆酿酱油
3.能证明澄清透明的矿泉水是混合物的实验是( )
A.取1~2滴矿泉水在玻璃片上蒸发 B.在矿泉水中滴入石蕊试液
C.仔细品尝矿泉水的味道 D.取一滴矿泉水放在显微镜下观察
4.钢铁在日常生产、生活中有广泛的用途,润扬长江公路大桥就用了16.3万多吨钢铁。下列家庭钢铁物品防锈措施无效的是( )
A.铁栅栏表面刷油漆 B.菜刀上撒盐水
C.自行车链条涂油 D.保持铁锅表面干燥
5.钙元素和铜元素的本质区别在于( )
A.元素符号不同 B.核外电子数不同
C.相对原子质量不同 D.核电荷数不同
6.现有液化石油气、天然气、氢气三种物质,根据它们的某种共性可将其归为一类物质,下列物质中也具有这种共性,可归为该类物质的是( )
A.O2 B.CO C.N2 D.CO2
7.下列物质在氧气中燃烧的实验现象描述,正确的是( )
A.蜡烛在氧气中燃烧时,有水和二氧化碳产生
B.镁条在氧气中燃烧时,发出白光并有黑色固体生成
C.铁丝在氧气中燃烧时,火星四射,有黑色固体熔化物生成
D.硫粉在氧气中燃烧时,有淡蓝色火焰产生,生成刺激性气味的气体
8.某同学喝一杯糖水,第一口与第二口“甜度”相同,这说明溶液是( )
A.混合物 B.均一的 C.澄清的 D.稳定的
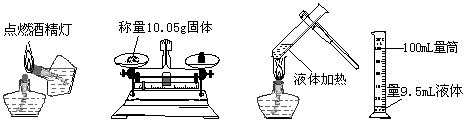 |
9.下列实验操作正确的是( )
A B C D
10.某同学设计了一个比较蔗糖和食盐溶解能力大小的实验方案,实验结果如下。
| 编号 | 使用的溶质(g) | 温度(℃) | 水(g) | 观察到的实验结果 |
| 1 | 食盐 | 20 | 80 | 最多能溶解食盐30g |
| 2 | 蔗糖 | 30 | 20 | 放入3g蔗糖全部溶解 |
| 3 | 蔗糖 | 20 | 20 | 最多能溶解蔗糖22g |
| 4 | 食盐 | 30 | 10 | 最多能溶解食盐3.8g |
从上表中分析得出的结论,其中正确的是( )
A.20℃时食盐的溶解度为30g B.20℃时蔗糖的溶解能力大于食盐
C.30℃时蔗糖的溶解度为15g D.30℃时食盐的溶解能力大于蔗糖
11.区分O2、H2、CO2三种气体的最简便的方法是( )
A.将气体通入澄清石灰水 B.将气体通过红热的铜网
C.将气体通过灼热的氧化铜 D.用燃着的木条伸入集气瓶中
12.烧柴禾时,通常把木柴架空一些才能燃烧更旺,这是因为( )
A.可以降低着火点 B.散热的速率快
C.木柴是可燃物 D.使柴禾和空气充分接触
13.绿色燃料物质X,其燃烧反应的化学方程式为X+2O2点燃CO2+2H2O ,根据质量守恒定律判断:X化学式为 ( )
A.H2 B.CH4 C.CH3OH D.C2H5OH
14.Na2CO3和CaCO3组成的混合物,经测定其中碳元素的质量分数为11.64%。则下列各项中:①钠元素的质量分数;②钙元素的质量分数;③氧元素的质量分数;④CaCO3的质量分数;⑤Na2CO3的质量分数;⑥Na2CO3和CaCO3的质量比。其中能确定的是( )
A.都不能确定 B.只有③能确定
C.只有④⑤⑥能确定 D.都能确定
15.锌粉、铝粉、铁粉、镁粉的混合物3.8g与一定质量的溶质质量分数为25%的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体(不含结晶水)11g,则反应中生成氢气的质量为( )
A.0.15g B.0.20g C.0.30g D.0.45g
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分)
16.将铁钉放入硫酸铜溶液发生反应,反应前后肯定发生变化的是 ( )
A.元素种类 B.溶液的质量
C.各元素的化合价 D.各种原子的数目
17.把400 g 20% 的氯化钠溶液稀释成10% 的溶液,可采取的措施是( )
A.蒸发200 g 水 B.加入200 g 水
C.加入400 g 水 D.加入40 g 氯化钠
18.下列说法,你认为正确的是( )
A.如果两种粒子属于同一种元素,则它们原子核中的质子数一定相同
B.如果两种粒子含有的质子数相同,则它们一定属于同一种元素
C.由同种元素组成的单质,则它们的性质相同
D.如果两种粒子含有相同的电子数,则它们一定属于同一种元素
19.在温度不变的情况下,将不含结晶水的某物质的溶液甲经历如下的变化:
![]()
据此,下列结论正确的是( )
A.若将甲溶液一次性蒸发20g水,则析出晶体5g
B.若将丙溶液再蒸发10g水,则析出的晶体质量一定大于5g
C.乙溶液和丙溶液中,溶质质量分数可能相同
D.若使甲溶液变为饱和溶液可采用加溶质、蒸发水、降低温度的方法
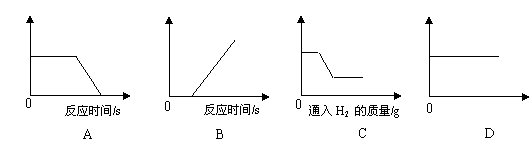 |
A.煅烧一定质量的石灰石
B.一定量的稀硫酸与锌粒反应
C.氢气还原一定质量氧化铜
D.一定温度下,向饱和硝酸钾溶液中加入硝酸钾晶体
三、(本题包括5小题,共22分)
21.(4分)用元素符号或化学式表示:⑴形成化合物种类最多的元素___________________;(2)2个氮分子______________;(3)2个汞原子_______________;(4) 空气中含量第二的元素与地壳中含量最多的金属元素形成的化合物__________。
22.(4分)我们学过的一些物质,在实际生活中有重要的用途。现有以下物质: A.不锈钢 B.氧气 C.生石灰(氧化钙) D.活性炭 E.二氧化碳 F.水 G.醋酸。请根据它们的用途,用字母代号填空(每种物质限选一次):(1) 可供急救病人呼吸;(2) 是最常用的溶剂;(3) 可用于制造炊具;(4) 可用作冰箱的除臭剂。
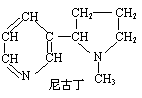 23.(4分)吸烟有害健康。如图为香烟中有害物质尼古丁的结构式(短线代表电子对),则该物质的化学式为 ,其中含有 种元素。该物质的相对分子质量为____________,其中质量分数最大的元素是___________。
23.(4分)吸烟有害健康。如图为香烟中有害物质尼古丁的结构式(短线代表电子对),则该物质的化学式为 ,其中含有 种元素。该物质的相对分子质量为____________,其中质量分数最大的元素是___________。
24.(4分) 已知25℃时硝酸钾的溶解度是36.0 g。某同学在50 g水中加入了16 g硝酸钾,搅拌,使硝酸钾全部溶解,得到_______ g溶液。要使该溶液变成25℃时的饱和溶液,可以继续加入______ g硝酸钾,或蒸发________ g水。还可以________________使其变成另一温度下的饱和溶液。
25.(6分)根据下列要求,各写出一个你所熟悉的化学方程式:
(1)有元素化合价变化的分解反应__________________________________________。
(2)单质与化合物参加的化合反应__________________________________________。
(3)除去氢气中混有二氧化碳的反应________________________________________。
四、(本题包括2小题,共12分)
26.(6分)水是宝贵的自然资源,对于人类生活、工农业生产都具有重要意义。
(1)你认为保持水的化学性质的粒子是_______________(填名称);能够证明水分子由氢元素和氧元素组成的实验事实是_____________________________________________。
(2) 自来水消毒的过程中,发生了水与氯气(Cl2)的反应,这个反应可以用图式形象地表示如下:
该反应的化学方程式为: 。
(3)我国是一个水资源短缺的国家。因此节约用水,人人有责。请你谈两点生活中节约用水的两点做法与同学交流。
①___________________________ ;
②_________________________________________________________________。
27.(6分)A是一种化合物,B、D、E是初中化学中三种常见气体,其中D、E具有还原性。物质A~F有如下图所示的转化关系(其中部分反应的反应物、生成物及反应条件未全部列出):
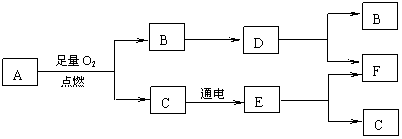 |
(1)若A是由两种元素组成的气体,两种元素的质量比为3:1,则A的化学式为 ;若A由三种元素组成,可用来作内燃机燃料,也可被氧化为醋酸,则A的化学式为 。
(2) 实验室中,检验物质B的试剂是 ;F属于___________(填“单质”或“化合物”。
(3)根据上述转化关系,写出一个属于置换反应的化学方程式
___________________________________________。
五、(本题包括3小题,共16分)
28.(4分) 现有下列仪器:①镊子、②烧杯、③试管、④胶头滴管、⑤药匙、⑥燃烧匙、⑦坩埚钳、⑧10mL量筒、⑨100mL量筒、⑩托盘天平等仪器。
 请为下列实验操作各选一种仪器(填写相应的序号):吸取或滴加少量液体时用
;可以直接在酒精灯火焰上加热的玻璃仪器是 ;硫在氧气中燃烧的实验用
;量取8mL的水用
。
请为下列实验操作各选一种仪器(填写相应的序号):吸取或滴加少量液体时用
;可以直接在酒精灯火焰上加热的玻璃仪器是 ;硫在氧气中燃烧的实验用
;量取8mL的水用
。
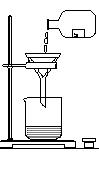
29.(4分) 某同学发现试剂瓶(细口瓶)中溶液里有悬浊物,拟用右图所示操作进行过滤,你认为其中错误的操作是:
(1)___________________;(2)____________________;
 |
(3)___________________;(4)_____________________。
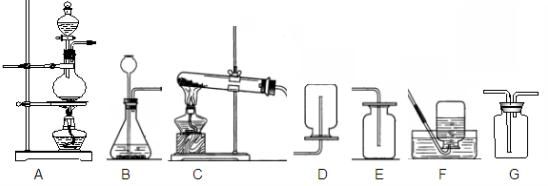
30.(8分)下列实验装置是初中化学实验室常用装置(除A外)。
Ⅰ:根据你的实验操作体会和认识,回答下列问题:
(1) 选择C与G或 组合成装置可制取干燥的氧气。
(2) 选B作制取气体的发生装置,应满足的条件是 。
(3) 若用G装置收集二氧化碳,从发生装置产生的二氧化碳应从G的____(填“左”或“右”)端通入,用来检验二氧化碳是否集滿的操作是___________________________。
(4) C装置稍作改进可以完成氢气还原氧化铜实验,改进方法是 。
Ⅱ:根据你对实验原理的理解和研究,尝试解答下列问题:
|
HCOOH ======= H2O+CO↑
(5)甲酸(HCOOH)分子中碳元素的化合价为____________。
(6)收集CO的装置应选用 (填序号)装置。
(7)你认为点燃CO前必须进行的操作是 __________ 。
(8)你认为与制取H2相比,制取CO的实验要注意___________________________。
六、(本题包括2小题,共10分)
31.(4分)某一混合气体样品,经测定只含有甲烷和一氧化碳两种气体。为了测定该气体的成分,现将3.0g该气体样品在氧气中充分燃烧,测得生成6.6g二氧化碳和3.6g水。试回答下列问题:
(1) 混合气体中氢元素与碳元素的质量比为____________________。
(2) 求混合气体中一氧化碳的质量分数。
32.(6分)甲、乙、丙三位同学对解答下列一道计算题因解法不同而产生争议,请你参与讨论并完成相关问题。(计算结果精确到0.01)
【原题】实验室现需0.96 L纯净的氧气(标准状况下,氧气的密度为1.429g/L)。现将2.45 g 氯酸钾和1.55 g 二氧化锰混合后放入试管中加热,当收集到0.96 L氧气后,停止加热并让试管冷却,称得试管内剩余固体的质量为2.80 g 。求生成氯化钾的质量。
①甲将0.96 L氧气直接代入化学方程式计算,直接求得生成氯化钾的质量为1.49 g 。
②乙认为2.45 g +1.55 g -2.80 g=1.20 g 是氧气的质量,进而求得生成氯化钾的质量。
(1)丙同学认为甲同学化学计算是错误的,你认为丙判断甲计算错误的原因是:______________________________________________________________。
(2)丙同学从乙同学的计算结果发现题目中数据有问题。你能通过计算,论证丙同学的发现?
(3)如何才能更正该题?甲、乙、丙三位同学都有自己的方法。但依据实验事实,宜将原题中“试管内剩余固体的质量为2.80 g ”改为“试管内剩余固体的质量为x g ”,其它物质的质量不变,则x 的取值范围是:___________________________。
2006年通州市初三化学期末试卷
参考答案及评分建议
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | A | B | D | B | C | B | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | D | B | D | A | B | C | A | AC | CD |
21.(1) C (2)2N2 (3)2 Hg (4)Al2O3 (每空1分,共4分)
22.⑴B ⑵F ⑶A ⑷D (每空1分,共4分)
23.C10H14N2 4 162 C (每空1分,共4分)
![]()
![]() 24.66 2 5.6 降温 (每空1分,共4分)
24.66 2 5.6 降温 (每空1分,共4分)
25.(1)2KMnO4 K2MnO4 +MnO2 +O2 ↑ (2)C+CO2 2CO
(3)CO2 +2NaOH=Na2CO3 +H2O (每空2分,共6分,其它合理答案参照给分)
26.(1) 水分子 通电后水分解成氢气和氧气 (2分) (2) H2O+Cl2=HCl+HClO(2分)
(3) 及时关好水龙头 用洗菜水冲厕所(2分,其它合理答案参照给分))
27.(1)CH4 (1分) C2H5OH(或C2H6O) (1分)
(2)澄清的石灰水 (1分) 单质 (1分)
(3)CuO+H2![]() Cu+H2O(或Fe2O3+3H2
Cu+H2O(或Fe2O3+3H2![]() 2Fe+3H2O等)(2分)
2Fe+3H2O等)(2分)
28.④ ③ ⑥ ⑧ (每空1分,共4分)
29.(1)漏斗下端没有靠近烧杯壁 (2)向过滤器中倒溶液时没有用玻璃棒引流 (3)试剂瓶标签没有对着手心 (4)试剂瓶塞没有向上放
30.(1) CE (2) 块状或颗粒状固体在常温下与液体反应 (3) 左 用燃着的木条接近右边的导管,看其是否熄灭 (4) 拨掉橡皮塞,将导管伸入到CuO的上方 (5)+2 (6) F (7)验纯 (8) 防止CO泄漏污染环境
31.(1) (1) 2∶9 (2分)
(2) 碳元素的质量:m(C)=6.6g×12/44 =1.8g
氢元素的质量:m(H)=3.6g×2/18 =0.4g
混合气体中氧元素的质量:m(O) =3.0g-1.8g-0.4g=0.8g
混合气体中CO的质量:0.8 g ×=1.4 g
混合气体中CO的质量分数:×100%=46.7% (2分)
答:该混合气体样品中CO为46.7% 。(其它合理答案参照给分,本题共4分。)
32.(1)误将0.96 L 作为1.6 g 代入化学方程式进行计算。 (1分)
(2) 设2.45 g KClO3 完全分解生成的氧气质量为 y

2KClO3 2KCl + 3O2 ↑ (1分)
245 96
2.45 g y
245∶2.45=96∶y y=0.96 g (2分)
0.96 g <1.20 g 所以题中数据有误。
(3)3.04g ≤x<4.00 g (2分)