初三化学复习 计算部分
相对原子质量:C:12 O:16 H:1 N:14 S:32 Fe:56 Cu:64
Ca:40 Cl:35.5 Na:23 Zn:65 K:39
一、计算物质的式量(分子量)和相对质量总和
CO2 2H2O
NH4NO3 2HCl
CO(NH2)2 CuSO4
二、计算化合物中各元素的原子个数比
C6H12O6 NH4NO3
C12H22O11 NH4HCO3
三、计算化合物中各元素的质量比
1. CO2
2. (NH4)2SO4
3. CuSO4
4. NaOH
四、计算元素的质量百分含量
求氮元素的质量百分含量
1. NO2
2. NH4NO3
3. CO(NH2)2
4. NH4HCO3
五、物质质量与元素的质量之间的换算
1. 求18克水中氢元素的质量
2. 求60吨尿素【CO(NH2)2】中氮元素的质量
3. 求多少千克硝酸铵【NH4NO3】中氮元素的质量为3.5千克
4. 求多少吨Fe2O3中炼得单质铁的质量为56吨
5. 求多少千克尿素【CO(NH2)2】中含氮量与10千克硝酸铵【NH4NO3】中含氮量相等?
六、其它
1. 求含等质量氧元素的NO、NO2的质量比
2. 求等质量的NO、NO2所含氧元素的质量比
3. 求含等质量铁元素的Fe2O3 、FeO、 Fe3O4中氧元素的质量比
| ||||
| ||||
七、
|
 溶液部分
溶液部分
(一) 计算溶解度
1.
|
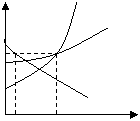
(1)A物质的溶解度曲线表明A物质
|
|
|
|
。
(3)40℃时,SA SB(填>,=,<)。
(4)40℃时,25克A物质最多能配成 克的饱和溶液。
(5)10℃时,75克C物质的饱和溶液中含C物质 克。
(6)在某温度下,若将C物质的不饱和溶液转变为饱和溶液,
可采用 、 、 的方法。
2. 已知20℃时,
(1)18克氯化钠溶解在50克水中配成饱和溶液,求该温度下氯化钠的溶解度。
(2)18克氯化钠能配成68克的饱和溶液,求该温度下氯化钠的溶解度。
3. 已知20℃时,氯化钠的溶解度是36克/100克水,求:
(1)150克水中最多能溶解多少克氯化钠?
(2)9克氯化钠最多能配成多少克饱和溶液?
(3)60克水中最多能溶解多少克的氯化钠?
4. 已知硝酸银在20℃时的溶解度是222克/100克水。求算在20℃时,将0.02克硝酸银固体在2毫升水中,能否配成饱和溶液?
(二) 计算浓度
1.50克10%的氯化钠溶液中,氯化钠和水各多少克?
2.求5克氯化钠溶解在95克水中,可配成浓度为多少的溶液?
3.若要将100克98%的浓硫酸稀释,可稀释成浓度为9.8%的稀硫酸多少克?需加水多少克?
5. 配制200克20%的硫酸溶液,需要98%的浓硫酸(ρ=1.84克/毫升)多少毫升?水多少毫升?
6. 求40℃时氯化钠的饱和溶液浓度为多少?(SNaCl=36克/100克水)
7. 已知70℃时,氯化铵饱和溶液的浓度为37.5%,求70℃时氯化铵的溶解度。
八、根据化学方程式计算
(一) 直接求算
1.8克氢气最多能还原多少克的氧化铜?
2.1.1克二氧化碳通入足量澄清石灰水中能生成多少克的沉淀?
(二) 差量法
4. 已知6.2克氯酸钾和二氧化锰的混合物,充分加热后剩余固体的质量为4.28克。求:(1)生成多少克的氧气?
(2)原混合物中有多少克的氯酸钾?
(3)剩余固体有哪些物质组成?质量为多少?
5. 木炭和氧化铜的固体混合物的质量为12克,在空气中充分加强热后剩余固体混合物的质量为10.9克。求:
(1) 生成二氧化碳的质量为多少克?生成铜多少克?
(2) 原混合物中所含氧化铜的质量百分含量
6. 碳酸钙和氧化钙的混合物质量为20克,充分煅烧后剩余固体质量为17.8克,求原混合物中碳酸钙的质量百分含量。
(三) 纯度
7. 纯度为80%的大理石100千克充分煅烧能生成多少千克的二氧化碳?还能生成纯度为90%的生石灰多少千克?
8. 足量的一氧化碳还原20吨赤铁矿(主要含氧化铁,杂质不与一氧化碳反应)能得到11.2吨的铁,求该赤铁矿的纯度。
(四) 溶液的计算
9.1.3克的锌粒最多能生成多少克的氢气?消耗浓度为10%的稀盐酸多少克?
10.200克10%的氢氧化钠溶液与200克硫酸铜溶液恰好完全反应。(1)求该硫酸铜溶液的浓度;(2)求所得溶液的浓度。
11.纯度为80%的大理石与172克稀盐酸恰好完全反应,反应后质量减少了22克。(1)生成二氧化碳的质量;(2)该大理石的质量;(3)所得溶液的浓度。
九、信息给予题
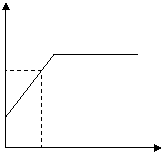
1. 实验室用加热氯酸钾和二氧化锰混合物的方法制取氧气,在制取的过程中,二氧化锰的质量分数(用WMnO2表示)随加热时间(t)的变化情况如图
(1)
 请你写出该反应的化学方程式 WMnO2
请你写出该反应的化学方程式 WMnO2
(2) 求在t1时间时氯酸钾的分解率
25%
20%
t1 t
2. 某同学为了测定实验室中氯酸钾样品的纯度,取2.5克该样品与0.5克二氧化锰混和。加热该混合物t1时间(假设杂质不参与反应),冷却,称量剩余固体质量。重复以上操作,依次称得加热t2、t3、t4时间后剩余固体的质量,记录数据如下表:
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(克) | 2.12 | 2.08 | 2.04 | 2.04 |
(1) 加热t3时间后氯酸钾是否已经反应完全?
(2) 求完全反应后产生氧气的质量
(3) 求该样品中氯酸钾的纯度。
3. 有一种石灰石的样品,其中含有的杂质是二氧化硅(二氧化硅是一种不溶于水,不与盐酸反应,耐高温的固体)。某同学想测定该样品的纯度,取用了2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体的质量如下表:
| 稀盐酸的用量 | 第一次(5克) | 第二次(5克) | 第三次(5克) | 第四次(5克) |
| 剩余固体质量 | 1.315克 | 0.63克 | 0.3克 | 0.3克 |
1)石灰石样品的纯度是多少?
2)20克稀盐酸的质量百分比浓度是多少?
3)100千克这种纯度的石灰石充分煅烧后,可得到固体多少千克?
4. 石灰石是常见的主要矿石之一,学校研究性学习小组为了测定某矿山石灰石中的碳酸钙的质量分数,取来一些矿石样品,并取来稀盐酸200克,平均分成4份,进行实验,结果如下:
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量(克) | 5 | 10 | 15 | 20 |
| 生成CO2的质量(克) | 1.76 | 3.52 | 4.4 | m |
1) 哪几次反应中矿石有剩余?
2) 上表中m的数值是多少?
3) 试计算这种石灰石中碳酸钙的质量分数。
