中考模拟(4)
(100分120分钟)
一、选择题(只有一个答案)
1.下列变化中属于物理变化的是 [ ]
A.干冰蒸发 B.白磷自燃
C.粮食酿酒 D.用氯酸钾制取氧气
2.下列各物质中,属于混合物的是 [ ]
A.空气 B.液氧 C.五氧化二磷 D.氯酸钾
3.下列叙述正确的是 [ ]
A.物质在发生变化的过程中,一定同时发生物理变化和化学变化
B.生成两种或两种以上其他物质的反应叫分解反应
C.由两种或两种以上的物质生成一种物质的反应叫化合反应
D.含Fe70%的氧化铁是混合物
4.一种元素跟另一种元素的最根本区别是原子的 [ ]
A.最外层电子数不同 B.核电荷数不同
C.电子层数不同 D.核外电子数不同
5.用托盘天平称量药品时,加4克砝码后天平指针向右偏移,则药品
质量是 [ ]
A.=4克 B.>4克 C.<4克 D.无法确定
6.X元素的原子最外层有7个电子、Y元素的原子核外有12个电子,
则X、Y两元素形成的化合物的化学式可能是 [ ]
![]()
7.一个原子变成阴离子 [ ]
A.一定失去了电子
B.一定得到电子
C.可能失去电子,也可能得到电子
D.既不失去电子也不得到电子
8.下列各微粒中,具有相同电子层数的是 [ ] ![]()
9.下列各物质受热分解,生成两种氧化物的是 [ ]
A.碳酸氢铵 B.碳酸钙 C.高锰酸钾 D.氧化汞
10.将一饱和石灰水变为不饱和溶液可采取的措施是 [ ]
A.升高温度 B.蒸发一部分溶剂
C.降低溶液的温度 D.加入一部分溶质
11.有一反应AB+CD=AD+CB中,a克AB和b克CD完全反应,生
成c克AD,同时也生成CB克数为 [ ]
A.a+b-c B.a+c-b
C.bc/a D.a-b-c
12.在t℃时,某固体物质的溶解度为m克,某饱和溶液的百分比浓度
是n%,那么m和n的正确关系是 [ ]
A.m>n B.m=n C.m<n D.以上答案都不对
13.提纯含有氯化钠的硝酸钾,最好的方法是 [ ]
A.溶解后蒸发 B.溶解后过滤
C.溶解后结晶 D.以上方法均可以
14.核外有10个电子、核内有11个质子和12个中子的微粒是 [ ]
A.原子 B.分子 C.阴离子 D.阳离子
15.下列物质含有氧分子的是 [ ]
A.水 B.二氧化碳 C.高锰酸钾 D.液氧
16.除去二氧化碳中混有的少量一氧化碳的最好方法是 [ ]
A.通过灼热的氧化铜 B.点燃混合气
C.通入水中 D.通入石灰水
17.关于空气的说法正确的是 [ ]
A.空气是由几种元素组成的混合物
B.空气是由几种化合物组成的混合物
C.空气是由几种单质和化合物组成的混合物
D.洁净的空气是纯净物
![]() [ ]
[ ]
A.一氧化碳 B.氧化铁
C.铁 D.二氧化碳
19.用氢气还原氧化铜的操作步骤主要有:
①加热试管
②冷却试管
③通入氢气
④停止通入氢气
⑤撤去酒精灯;正确操作顺序是 [ ]
A.②③①④⑤ B.③①⑤②④
C.①③②④⑤ D.①②③④⑤
20.有关化合价的说法,不正确的是 [ ]
A.在化合物里,金属元素总显正价,非金属永远显负价
B.单质里元素的化合价为零
C.化合物里,正负化合价的代数和为零
D离子化合物,元素化合价的数值,就是这种元素的一个原子得失
电子的数目
21.在相同数目的水和硫化氢分子中 [ ]
A.含有相同数目的氢分子
B.含相同数目的氢原子
C.含相同数目的氢元素
D.含相同数目的氧原子
22.下列操作中错误的是 [ ]
A.皮肤不慎沾上浓硫酸,立即用水冲洗,再涂上3-5%的碳酸氢钠溶液
B.配制5%的氢氧化钠溶液100克,可用量筒量取95毫升水,用天平准确
称量5克氢氧化钠固体
C.检查装置的气密性,应先将导管一端浸入水中,再用双手紧贴容器外壁
D.玻璃管与橡皮管连接,应左手拿像皮管,右手拿玻璃管,管口用水湿润,
进行连接
23.下列叙述正确的是 [ ]
A.二氧化锰是氯酸钾制氧气时的催化剂
B.二氧化锰是所有反应的催化剂
C.共价化合物中元素的化合价不分正负
D.含氧化合物就是氧化物
24.比钠原子多1个质子或者少1个电子的微粒是 [ ]
![]()
25.对质量守恒定律的解释正确的是 [ ]
A.化学反应前后,分子的种类和数目不变
B.化学反应前后,电子的总数不变
C.化学反应前后,原子的种类、数目、原子的质量都不变
D.化学反应前后,原子种类虽然改变,但数目不变
26.下列物质燃烧时,火焰为蓝色的是 [ ]
A.碳 B.一氧化碳 C.磷 D.镁
27.放平稳的量筒内盛有20毫升液体,某同学读数为19.8毫升,造成
误差的原因是 [ ]
A.视线与凹液面的最低处保持水平 B.俯视
C.仰视 D.无法知道
28.t℃时,某固体m克溶于水,得M克浓度为C%的溶液,在此溶液
中再加入这种固体n克,恰好形成浓度b%的该温度下的饱和溶
液,这种固体在t℃时的溶解度是 [ ]

29.下列实验操作中主要并非从安全因素考虑的是 [ ]
A.点燃氢气前一定要检验氢气纯度
B.未使用完的白磷要及时收集起来,并与空气隔绝
C.用氢气还原氧化铜,反应完毕时,要先停止加热,继续通氢气,至
试管冷却
D.水不能往浓硫酸里倒
30.下列各组物质:①氯化钠和硝酸钠,②碳酸钙和氯化钙,③氯化钾
和二氧化锰,④硫酸钡和氯化银.
可以按溶解、过滤、蒸发的操作顺序将它们一一分离的是 [ ]
A.只有① B.③和④ C.②和③ D.只有③
二、选择题(下列各题均有1或2个正确答案)
1.下列对氧气的描述不正确的是 [ ]
A.固态氧是无色雪状固体
B.氧气与硫的反应既是氧化反应也是化合反应
C.氧气的化学性质比较活泼
D.氧气可用于灭火
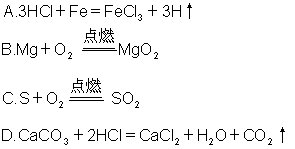
2.下列化学方程式,正确的是 [ ]
3.在①试管②滴瓶③量筒④烧杯中,都能做反应容器的一组是 [ ]
A.①② B.③④ C.②③ D.①④
4.下列微粒中的电子总数和氖原子的核外电子总数相等的是 [ ]
![]()
5.一氧化碳不能用排空气法收集是因为 [ ]
A.密度与空气非常接近 B.易溶于水
C.有剧毒 D.无色
6.镁和碳酸镁的混合物在空气中充分灼烧,冷却后称量剩余物和原混
合物质量相等,则原混合物中碳酸镁的百分含量为 [ ]
A.28% B.44% C.56% D.72%
7.下列除去杂质的方法中正确的是 [ ]
A.水中混有硫酸,可加入适量氢氧化钠除去
B.硝酸铁溶液中混有少量硝酸银、硝酸钡,可先加适量硫酸铁
溶液,再滴入适量氯化钡溶液,过滤除去
C.硝酸钾中混有少量氯化钠,可加入适量硝酸银,过滤除去
D.硝酸钠中混有少量硫酸镁,可加入适量氢氧化钡溶液,过滤除去
8.氢气和氧气的混合气体共20克,充分反应后得到18克水,则原混
合气体中氧气的质量可能是 [ ]
A.2克 B.4克 C.16克 D.18克
9.t℃时,62.5克7.2%的硫酸铜溶液中加入12.5克胆矾恰好饱和,
则t℃硫酸铜的溶解度是 [ ]
A.20克 B.25克 C.30克 D.15克
10.有13.5克氯化铜样品,当它与足量硝酸银溶液反应后得到氯化银
29克,则样品中可能混有的盐是 [ ]
A.氯化钡 B.氯化汞 C.氯化锌 D.氯化镁
三、填空题
1.空气中氧气和氮气的体积比大致是________;水中氢元素与氧元素
的质量比是_______.
2.写出下列各符号中“2”表示的含义

3.写出由铜、氢、氧、硫四元素组成一种含氧酸的化学式_________,
一种含氧酸盐的化学式__________,一种无氧酸的化学式___________,
一种碱的化学式_________.
![]()
放出______气(写化学式)而使肥料失效.
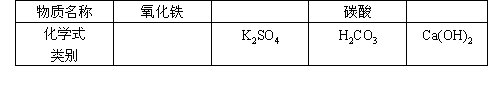
5.填写下表中空格(类别指单质、氧化物、酸、碱、盐)
6.三氧化硫的式量是_________;20克三氧化硫中含硫元素的质量是
___________克.
![]()
剂,________被氧化,_______被还原.
8.将相同质量的铝片、锌片、和铁片,分别与足量的盐酸反应,其中
产生氢气最快的是_______,反应完后产生氢气最多的是________.
9.80克与100克的两份饱和食盐溶液各蒸发10克水,析出晶体食盐
质量________.200克与300克50℃时饱和氯化钾溶液同时降到
20℃析出晶体质量________.(以上填相同或不同)
10.为了除去下面标号(1)-(4)物质中的杂质(括号内为杂质),可选
用的实验方法有a-d所叙,试将选用的实验方法的序号填入横线上.
实验方法:
a.加适量水溶解,过滤.
b.高温灼烧.
c.加适量盐酸,蒸发溶剂结晶.
d.加适量稀硝酸,过滤.
(1)碳酸钙(碳酸钠)________(2)氯化钾(碳酸钾)__________
(3)氧化钙(碳酸钙)________(4)硫酸钡(氧化镁)___________
四、如果只有一种(或不用)试剂,将下列物质中的杂质除去,并写
出有关化学方程式
1.盐酸中混有少量硫酸
2.氧化钙中混有少量碳酸钙
3.氢氧化钠中混有少量碳酸钠
4.二氧化锰中混有少量木炭粉
五、用实验证明:
1.氧化钙、二氧化碳各是哪类物质
2.锌、铜、汞三种金属的活动性顺序是Zn>Cu>Hg
六、计算题
![]()
质量相当?(保留一位小数)
2.烧杯内盛放蒸馏水44.1克,投入5.1克不纯的食盐样品(其中所含
杂质不溶于水),充分搅拌,使样品中氯化钠完全溶解.经过滤后,再
取出滤液5.85克并向其中滴加硝酸银溶液,到不产生沉淀为止.将
沉淀氯化银充分烘干后称量,其质量为1.435克.试求:
(1)过滤所得滤液的质量百分比浓度是多少?
(2)原不纯食盐样品中氯化钠的百分含量是多少?(保留1位小数)
3.用含杂质(杂质不与稀硫酸反应)5%的铁与42.98毫升,密度为
![]()
(密度为0.09克/升)求:
(1)需含杂质的铁多少克?
(2)此稀硫酸的百分比浓度是多少?