化学综合练习(十)
一、选择题(每小题只有一个正确答案)
1. 空气质量日报是环境监测部门对一个地区空气质量状况所做的监测报告。目前计入空气主要污染物的是可吸入颗粒物、一氧化碳、二氧化硫、氮的氧化物。下列情况能直接造成空气污染的是
A. 把煤作为主要燃料 B. 随意丢弃塑料垃圾
C. 随意丢弃废电池 D. 利用太阳能、风能等清洁能源
2. 下列变化,前者属于物理变化,后者属于化学变化的是
A. 水结冰 冰融化 B. 酒精挥发 酒精燃烧
C. 铁生锈 电灯通电发光 D. 鸡蛋变臭 火药爆炸
3. 三聚磷酸钠(Na5P3O10)过去常用作洗衣粉的辅助剂,我国部分省市为防止水体富营养化已禁止销售和使用含磷洗衣粉。在Na5P3O10中磷元素的化合价为
A. +3 B. +4 C. +5 D. +6
4. 下列叙述中,正确的是
A. 二氧化碳分子是由一个碳原子和一个氧分子构成的
B. 不同元素的原子的核电荷数一定不同
C. 核外电子排布相同的粒子一定属于同种元素 D. 原子是构成物质的最小粒子
5. 在一个密闭容器中有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,该密闭容器中发生的反应属于
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 2 | 3 | 111 | 6 |
| 反应后质量/g | 24 | 待测 | 0 | 15 |
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
6. 据2005年5月18日《贵州都市报》报道:“日前,中国科技大学齐飞教授领导的研究小组,首次在实验中发现了一系列碳氢化合物氧化过程中的重要中间体——烯醇,其中最简单的烯醇是乙烯醇(C2H4O)”,则下列说法正确的是
A. 乙烯醇是一种混合物 B. 乙烯醇中含有碳、氢、氧三种单质
C. 乙烯醇分子中碳、氢、氧的原子个数比为2:4:1
D. 乙烯醇中碳、氢、氧元素的质量比为12:1:16
7. 在①Cu、Mg、C、Hg ②CO2、CuO、P2O5、H2O ③HCl、H2SO4、HNO3、Na2SO4三组物质中,各有一种物质在分类上与组内其他物质不同,这三种物质分别是
A. Cu、P2O5、H2SO4 B. Hg、CO2、HCl C. C、CuO、Na2SO4 D. Mg、H2O、HNO3
8. 做化学实验必须注意安全。下列属于安全操作的是
A. 用嘴吹灭燃着的酒精灯 B. 点燃氢气前,检验氢气的纯度
C. 加热试管中的液体时,试管口对着人
D. 浓硫酸不慎沾在手上,立即涂上大量氢氧化钠溶液
9. 据报道,2005年3月,广州市实施大面积人工降雨,其中使用了液氮作增雨剂。根据你现有的知识推测下列说法中正确的是
A. 液氮是一种溶液 B. 使用液氮会污染环境,应严格控制使用
C. 降落的雨滴中将含有大量的液氮 D. 液氮气化使空气中的水蒸气凝结成水珠落下
10. 为除去CO2中含有的少量CO杂质,下列操作中正确的是
A. 将气体点燃 B. 将气体通入澄清石灰水中
C. 将气体通入硫酸溶液中 D. 将气体通过灼热氧化铜
二、选择题(每小题有1~2个正确答案)
11. 下列认识或做法中,正确的是
A. 借助酚酞试液可完成稀盐酸、NaCl溶液、NaOH溶液、K2CO3(草木灰的主要成分)溶液间的鉴别 B. 铁能和稀硫酸、CuSO4溶液、Cu(OH)2发生置换反应
C. NaOH能和盐酸、CuSO4溶液、K2SO4溶液反应
D. 用过量的CuO提纯混有盐酸的CaCl2溶液
12. 小颖同学为探究X、Y、Z三种金属(都不是银)的活动性顺序,做了以下实验:
(1)把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;
(2)把Y和Z分别放入硝酸银溶液中,在Y表面有银析出,而Z没有变化。
根据以上实验事实,下列金属活动性顺序由强到弱排列正确的是
A. X>Y>(H)>Z B. X>Y>Ag>Z C. X>Y>Z>Ag D. X>(H)>Y>Z
13. 8.4g不纯的碳酸镁与足量的稀盐酸反应产生4.4g二氧化碳,则不纯的碳酸镁中可能含有的杂质是 A. 碳酸钠 B. 碳酸氢钠 C. 碳酸钙 D. 碳酸钾
14. 甲、乙、丙、丁分别是HNO3、Ba(OH)2、Na2CO3、NaOH四种溶液中的一种。已知乙和丙可以反应,乙和丁也可以反应,则下列说法正确的是
A.乙一定是HNO3 B.丁一定是Na2CO3 C.丙不可能是Ba(OH)2 D.甲不可能是HNO3
15. 已知KNO3在不同温度下的溶解度如下表,下列说法不正确的是
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
A. 20℃时KNO3的溶解度为31.6g B. KNO3的溶解度随温度升高而增大
C. 30℃时,在100g KNO3饱和溶液中含有45.8g KNO3
D. 40℃时的饱和KNO3溶液,降温可使它变浓
三、(本大题共5题)
16. 现有氮气、氢气、氧气、二氧化碳、碳、一氧化碳、碳酸钙、甲烷八种物质,请按要求填写下列空白。(用化学式填写)
(1)约占空气总体积4/5的是________;(2)被称为“零污染燃料”的气体是_______;
(3)其固体易升华,可作致冷剂和用于人工降雨的是________;
(4)有毒性,可燃烧的气体是______;(5)能用于抢救病人,供给呼吸的气体是:______;
(6)在国家西部大开发战略中的“西气东输”的气体主要成分是________;
 (7)金刚石的成分是________; (8)大理石的主要成分是_________。
(7)金刚石的成分是________; (8)大理石的主要成分是_________。
17. 某学生在研究分子的性质时,做如图所示实验。在一个小烧杯里放半杯水,然后用药匙取一小粒品红,放入烧杯,观察到品红在水中__________。此实验说明分子具有的性质是 。
18. 图A是元素周期表的一部分(图B是相关示例)
| 第二 周期 | 3 Li 锂 7 | 4 Be 铍 9 | 5 B 硼 11 | ① | 7 N 氮 14 | 8 O 氧 16 | 9 F 氟 19 | 10 Ne 氖 20 |
| 第三 周期 | ② | 12 Mg 镁 27 | 13 Al 铝 27 | 14 Si 硅 28 | ③ | 16 S 硫 32 | 17 Cl 氢 35.5 | 19 Ar 氩 40 |
回答下列问题:(1)原子序数为17的元素名称为_______________;
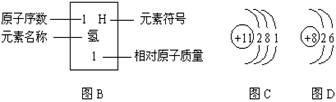 (2)图C是某元素的原子结构示意图,该元素在图A中的位置是(选填①或②或③)_______;(3)图D是氧元素的原子结构示意图,图A中与氧元素在同一纵行的硫元素其原子结构与氧原子相似。由此推测,硫原子在化学反应中易(填“得”或“失”)_______电子。
(2)图C是某元素的原子结构示意图,该元素在图A中的位置是(选填①或②或③)_______;(3)图D是氧元素的原子结构示意图,图A中与氧元素在同一纵行的硫元素其原子结构与氧原子相似。由此推测,硫原子在化学反应中易(填“得”或“失”)_______电子。
19. t1℃时,将3g生石灰加入到60g a%的饱和石灰水中,保持温度不变,所得溶液的质量(填“>”、“<”或“=”,下同) _______60g,溶液中溶质的质量分数________a%;若将该溶液的温度升高到t2℃,此时所得溶液中溶质的质量分数_________a%。
20. 除去氯化钠溶液中混有的少量硫酸钠,可选用的除杂试剂是 ;除去硫酸亚铁溶液中混有少量硫酸铜,可选用的物质是 。
四、(本大题共3题)
21. 稀硫酸有许多用途,按要求各写出一个有关反应的化学方程式。
| 序号 | 用途 | 反应化学方程式 |
| ① | 用稀硫酸制硫酸钠 | |
| ② | 用稀硫酸除铁锈 | |
| ③ | 用稀硫酸制硫酸铜 | |
| ④ | 证明“银粉”成分是铝不是银 |
22. 用化学方程式回答下列问题:
(1)用石灰浆粉刷墙壁,刚开始一段时间内墙壁会“出汗”(墙壁出现潮湿现象),原因是_____________________________________________;
(2)人在剧烈运动后,血液中产生较多的乳酸(化学式为C3H6O3),使肌肉酸痛,放松一段时间后,由于乳酸与吸入的氧气反应而生成二氧化碳和水,使肌肉的酸痛感消失,该反应的方程式是____________________________________。
23. 将一些可溶性化合物溶于水,得到的A、B两种溶液里共含有H+、Ba2+、Na+、OH—、NO3—、CO32—六种离子,A、B两溶液所含离子各不相同,已知A溶液中滴入紫色石蕊试液,变成红色。则A溶液中所含离子是 ;B溶液中所含离子是 。
 五、(本大题共3题)
五、(本大题共3题)
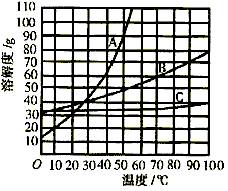
24. 下图为A、B、C三种固体物质在水中的溶解度曲线。据图回答:
(1)40℃时,A物质的溶解度为_________g;
(2)50℃时,B、C两物质的饱和溶液中溶质质量分数更大的是_________;
(3)要从C的饱和溶液中得到大量的晶体,应采用结晶方法中的_________。
25. 某学生在配制100g质量分数为5.1%的氯化钠溶液时,操作为:①在托盘天平的左边加5g砝码,移动游码到0.1g;右边加氯化钠,直到天平平衡,把称量好的氯化钠倒入烧杯里。②用100mL的量筒量取94.9mL水时仰视读刻度数。将水倒入装有氯化钠的烧杯里,搅拌使氯化钠完全溶解。
指出上述操作中的错误及可能产生的后果。
①中的错误是 ,后果是 。
②中的错误是 ,后果是 。
 26. 在探究CO2和NaOH是否发生化学反应时,某同学设计出下列6种实验装置。
26. 在探究CO2和NaOH是否发生化学反应时,某同学设计出下列6种实验装置。
(1)6个实验是否都能提供CO2跟NaOH发生化学反应的证据?请逐一简述出现的实验现象: ;
(2)上述6种实验设计所依据的共同原理是 ;
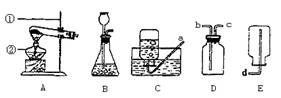 (3)如果有同学质疑,认为上述实验设计没有排除CO2可能易溶解于NaOH溶液的假设,你如何进一步设计实验证明CO2和NaOH肯定发生了化学反应?描述实验的操作步骤、现象和结论。
(3)如果有同学质疑,认为上述实验设计没有排除CO2可能易溶解于NaOH溶液的假设,你如何进一步设计实验证明CO2和NaOH肯定发生了化学反应?描述实验的操作步骤、现象和结论。
六、(本大题共3题)
27. 根据下列实验装置图回答(装置用序号表示):
(1)写出编号为①②的仪器名称:① ,② 。
(2)实验室制取O2应选用的发生装置是__________;实验室制取CO2应选用的发生装置是__________。
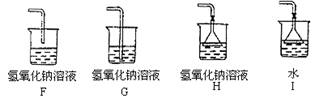 (3)硫化氢是一种有毒的气体,其密度比空气大,能溶于水,它的水溶液叫氢硫酸。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸在常温下反应制取硫化氢气体,制取气体应选用的发生装置是__________,收集装置是__________,气体由__________(填导管口代号)导入集气瓶。
(3)硫化氢是一种有毒的气体,其密度比空气大,能溶于水,它的水溶液叫氢硫酸。实验室通常用块状固体硫化亚铁(FeS)与稀硫酸在常温下反应制取硫化氢气体,制取气体应选用的发生装置是__________,收集装置是__________,气体由__________(填导管口代号)导入集气瓶。
(4)收集气体后,对H2S尾气要进行特别处理,以防止污染环境。现有如下装置, 处理H2S尾气的效果最好的装置是________________。
28. 有一包固体粉末,可能由CaCO3、Na2SO4、Na2CO3、CuSO4和BaCl2中的一种或几种组成,做实验得以下结果:
(1)此固体粉末加到水中,得到白色沉淀,上层清液为无色; (2)滴入足量稀硝酸后白色沉淀部分溶解。从实验可判断出,该粉末可能的三组组成:
<1> ;<2> ;<3> 。
29. A、B、C、D四个试剂瓶中分别盛碳酸钠、硝酸银、烧碱、稀硫酸四种稀溶液中的一种,取四种溶液各少量,依次滴入物质X的溶液和稀硝酸,发生的现象如下表所示:
| A | B | C | D | |
| X | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无现象 |
| 稀硝酸 | 沉淀不消失 | 沉淀消失,有气体产生 | 沉淀不消失 | 无现象 |
回答:(1)物质X的化学式是_________。
(2)物质B是________,加入X后反应的化学方程式是 ,加稀硝酸后,沉淀消失的反应化学方程式是___________________________。
(3)为进一步区别A和C,可根据置换反应的原理进行实验,写出其中一个反应的化学方程式___________________________。
七、(本大题共2题)
30. 维生素是人体必备的营养物质,某种维生素D2的化学式为C28H44O,计算:
(1)维生素D2的相对分子质量 ;(2)维生素D2中的碳、氢、氧三种元素的质量比 ;(3)198g维生素D2中含碳元素_____________g。
31. 为测定某硝酸银溶液中硝酸银的含量,取20g溶液于烧杯中,加入5.5g盐酸(足量)使溶液中的硝酸银完全反应,将产生的白色沉淀过滤、洗涤、干燥后,称量为2.87g。
(1)求上述20g溶液中AgNO3的质量。
(2)在实验操作中,通常是通过量取液体的体积来取用一定量的液体,查得上述盐酸在实验条件下的密度为1.1 g/mL,则在本实验中所用的5.5g盐酸的体积是多少mL?
综合练习十参考答案:
1.A 2.B 3.C 4.B 5.B 6.C 7.D 8.B 9.D 10.D 11.A 12.BD 13.B 14.D 15.CD 16.(1)N2;(2)H2;(3)CO2;(4)CO(5)O2;(6)CH4;(7)C (8)CaCO3
17. 溶解 分子是不断运动的
18.(1)氯;(2)②;(3)得
19. < = <
20. BaCl2 Fe
21.略
22.略
23. H+、Ba2+、NO3—; OH—、CO32—、Na+
24.(1)60;(2)B;(3)蒸发溶剂
25.(1)把砝码和物体放颠倒了 称量的溶质质量不足;
(2)量取水时,仰视读刻度数 使量取的水比实际需要的水多
26.(1)实验①,反应后有溶液进入试管内;实验②,反应后倒置可发现玻璃片被吸住;实验③,反应后塑料饮料瓶被压瘪;实验④,反应后气球会充气鼓起来;实验⑤,反应后烧瓶中有“喷泉”出现;实验⑥,反应后烧杯中的水被吸到锥形瓶中;
(2)反应后,盛有CO2的容器内压强减小,同外界大气压产生压强差
(3)取少量反应后的溶液于试管中,滴入稀盐酸,如果出现气泡,则说明CO2确定同NaOH发生化学反应,生成了碳酸盐。
27. (1)铁架台 酒精灯;(2)A B;(3)B D b;(4)H
28. (1)CaCO3、Na2SO4、BaCl2;(2)Na2CO3、Na2SO4、BaCl2;(3)CaCO3、Na2SO4、Na2CO3、BaCl2
29.(1)BaCl2;(2)碳酸钠(或Na2CO3或纯碱)Na2CO3 + BaCl2 === BaCO3↓ + 2NaCl
BaCO3 + 2HNO3 === Ba(NO3)2 + H2O +CO2↑(3)Fe + 2AgNO3 === Fe(NO3)2 + 2Ag(或Fe + H2SO4 === FeSO4 + H2↑)
30.(1)396;(2)84:11:4;(3)168
31.(1)3.4g;(2)5mL
