中考模拟(3)
(100分 120分钟)
一、选择题(只有1个正确答案)
1.![]() [ ]
[ ]
A.大理石、稀盐酸 B.生石灰、稀盐酸
C.熟石灰、稀盐酸 D.石灰石、稀硫酸
2.下列物质中,具有还原性的是 [ ]
![]()
3.下列各组金属中,按金属活动性由弱到强排列的是 [ ]
A.Ca、Mg、Fe、Cu
B.Fe、Cu、Ca、Mg
C.Cu、Fe、Mg、Ca
D.Fe、Ca、Mg、Cu
4.下列各组名称中,表示同一种物质的组是 [ ]
A.水、冰、干冰
B.胆矾、蓝矾、硫酸铜晶体
C.烧碱、火碱、纯碱
D.大理石、石灰石、生石灰
5.下列化学方程式中,正确的是 [ ]
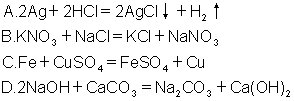
6.下列电离方程式中,正确的是 [ ]
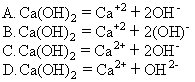
7.粗盐提纯实验的主要过程是 [ ]
A.溶解、蒸发、结晶
B.溶解、过滤、蒸发
C.溶解、结晶、过滤
D.过滤、结晶、溶解
8.在氧气中完全燃烧相同质量的下列物质,消耗氧气最少的是 [ ]
A.CO B.S C.P D.C
9.将t℃时的某固体纯物质的饱和溶液22.5克蒸干,得到了2.5克
固体,在t℃时,该物质的溶解度为 [ ]
A.2.5克 B.5克 C.10克 D.12.5克
![]()
次将它们鉴别出来,这种试剂是 [ ]
A.氢氧化钠 B.稀硫酸 C.氯化钡 D.氯化钾
11.下列物质中长期暴露在空气中不变质但质量减少的是 [ ]
A.浓盐酸 B.浓硫酸 C.烧碱 D.熟石灰
12.下列各组物质都能导电的一组是 [ ]
A.浓硫酸、食盐、硝酸钾晶体
B.无水酒精、硝酸铵、烧碱
C.熔化的氢氧化钠、氯化氢气体、液态蔗糖
D.硫酸镁溶液、液态汞、烧碱溶液
13.在化学变化中不发生变化的是 [ ]
A.原子的最外层电子数
B.原子的电子层数
C.物质的形态
D.原子核内中子数
14.下列物质中属于纯净物的是 [ ]
A.碳酸氢铵加热后生成的混合气体
B.高锰酸钾分解生成的固态物质
C.氯酸钾和二氧化锰共热生成的固态物质
D.碳酸钙完全煅烧后生成的固态物质
15.贮藏氢氧化钠的试剂瓶的瓶塞应该用 [ ]
A.橡皮塞 B.玻璃塞
C.磨石玻璃塞 D.软木塞
16.托盘天平的指针不在零位而偏右时就称量物质,称得物质的质量
比实际质量会 [ ]
A.相等 B.偏大 C.偏小 D.无法比较
17.在饱和硫酸铜溶液中加入无水硫酸铜后,保持温度不变,溶液的质
量会 [ ]
A.增大 B.减小 C.不变 D.无法比较
18.既能与盐酸反应,又能与烧碱溶液反应的是 [ ]
A.铁屑 B.碳酸钠溶液
C.碳酸铵溶液 D.硝酸钠溶液
19.有四瓶无色溶液:氯化钠、亚硫酸钠、硫酸铵、硝酸铵,仅用一种试
剂即可将它们区别开来,这种试剂是 [ ]
A.红色石蕊试液 B.硝酸银溶液
C.氢氧化钡溶液 D.氯化钡溶液
20.一种无色液体与氯化钡溶液反应,生成不溶于稀硝酸的白色沉淀,
这种液体一定是 [ ]
A.可溶性银盐
B.硫酸或可溶性硫酸盐
C.硫酸或可溶性硫酸盐或可溶性银盐
D.可溶性硝酸盐或磷酸盐
21.用稀盐酸和酚酞混合液在白纸上画图,晾干后加入下列物质
能使此纸上出现红色图象的是 [ ]
A.过量盐酸 B.水中溶有三氧化硫的溶液
C.过量氢氧化钠溶液 D.适量石蕊试液
22.只用①硫酸铁、②碳酸钠、③硝酸银中的一种就能将氯化钡、
盐酸、氢氧化钠三种无色溶液一次鉴别出的有 [ ]
A.①或② B.①或③
C.①或②或③ D.②或③
23.能和氢氧化钠共存于水中的物质是 [ ]
A.硝酸铜 B.硫酸 C.二氧化碳 D.硝酸钾
24.下列物质的转变,不能一步反应实现的是 [ ]
A.氯化镁→硝酸镁
B.硫酸钾→氢氧化钾
C.氯化银→氯化铜
D.二氧化硅→硅酸钙
25.相同质量的下列物质与过量盐酸发生反应,放出气体质量最多的
是 [ ]
A.镁 B.铝 C.碳酸钠 D.碳酸氢钠
26.20℃时某物质的不饱和溶液其浓度为10%,若蒸发掉32克水或
加入5克该物质都可以成为饱和溶液,那么该物质在20℃时的溶
解度为 [ ]
A.13.4克 B.15.6克 C.16.7克 D.无法计算
27.X克氯酸钾与5克二氧化锰混合加热一段时间后,残留物固体质
量为Y克,则分解了的氯酸钾质量为 [ ]
A.(X-Y)克
![]()
![]()
D.Y-5克
28.硝酸铁溶液中混有少量硝酸银和硝酸钡杂质,用下列哪一种方
法除杂质可以得到纯净的硝酸铁溶液 [ ]
A.先加适当盐酸,再滴加适量硫酸
B.先加入适量氢氧化钠,再滴入适量氯化钾溶液
C.加入适量碳酸钠
D.先加入适量氯化钡,再滴入适量硫酸铁溶液
29.将A克溶质完全溶解于B克水中,若要使所得溶液的质量百分比
浓度增大一倍(不考虑饱和),可以 [ ]
A.蒸发掉B/2克水
B.蒸发掉(A+B)/2克水
C.再加入A/2克溶质
D.再加入A/2克溶液
30.由X和Y元素组成的化合物A、B,A中含X 44.0%,B中含X
![]() [ ]
[ ]
二、选择题(有1-2个正确答案)
1.点燃气体后,在火焰上方罩一个干燥而冷的烧杯,当烧杯内壁有水珠出
现时,把烧杯迅速倒过来,即向烧杯内注放少量澄清石灰水,振荡,石灰
水变浑浊,该气体可能是 [ ]
A.甲烷 B.氢气
C.一氧化碳 D.一氧化碳和氢气的混合气体
2.下列各组溶液反应时加热,既有气体产生,又有白色沉淀产生的一
组是 [ ]
A.硝酸银和氯化钠
B.氢氧化钡和硫酸铵
C.氯化钠和硫酸
D.氢氧化钾和盐酸
3.用氢气还原氧化铜的实验,有a到e的操作,进行的正确顺序是 [ ]
a加热;b冷却;c通入氢气排除空气;
d撤去酒精灯;e继续通入氢气
A.c a d e b
B.a c e b d
C.c a e b d
D.a b c d e
4.下列电离方程式中,书写正确的是 [ ]

5.有浓度相同的三种溶液:甲、氯化钠;乙、盐酸;丙、氢氧化钙,其
pH值由小到大的顺序是 [ ]
A.甲<乙<丙 B.乙<甲<丙
C.丙<乙<甲 D.甲<丙<乙
6.把铁片分别投入下列溶液里,溶液的质量会减少的是 [ ]
A.稀硫酸 B.硫酸铜
C.硫酸锌 D.硫酸亚铁
7.下列微粒的结构示意图中,属于+2价阳离子的是 [ ]
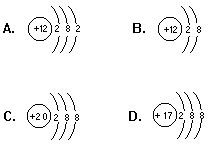
8.下列金属(原子个数相同)分别与足量的稀盐酸反应,可以生成氢气
的质量最多的是 [ ]
A.Cu B.Zn C.Fe D.Al
9.把含有二氧化锰20%的氯酸钾加热制成氧气,当二氧化锰含量升至
25%时,氯酸钾的分解率约是 [ ]
A.15% B.20% C.25% D.64%
10.一定量的二氧化碳气体通入过量澄清石灰水中,得到X克碳酸钙沉淀,
若先将二氧化碳通过下列变化:二氧化碳→一氧化碳→二氧化碳,
再将得到的二氧化碳气体通入过量澄清石灰水中,得到Y克碳酸钙沉
淀,则X与Y的关系是 [ ]
A.X<Y B.X>Y C.X=Y D.无法确定
三、填空
1.用化学式表示下列物质
氯化钠_____________氢氧化钠________
碳酸钙_____________硝酸______________
硫酸氢钾___________碱式碳酸铜_____________
2.在化学反应中,反应前后原子的种类______改变,原子的数目________
________增减,各种原子的质量________变化.所以,化学反应前后各物质
的质量总和必然_____________.
3.在电解水的实验中,电源负极所在容器中的气体是_____________,它的
体积约为另一容器内气体体积的________________.
4.在氧气、二氧化碳、一氧化碳、甲烷四种气体中,可以用做为燃料的是
__________,可以用灭火的是_________,可供呼吸的是________,有剧毒
的是__________.
5.从H、O、S、Na四种元素中,选择适当的元素,按下列要求,各
写出一种可以得到的物质的化学式.
(1)金属氧化物________(2)非金属氧化物_________
(3)无氧酸____________(4)含氧酸_______________
(5)碱________________(6)酸式盐_______________
6.现有甲、乙两组物质

已知乙组中有一种物质可以跟甲组中的所有物质发生化学反应,这种
物质是_______.有关反应的化学方程式为:
(1)_______________
(2)_______________
(3)_______________
7.配平下列化学方程式
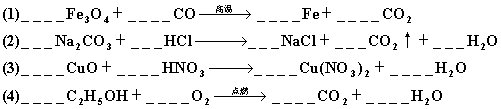
四、判断题
![]()
R占总质量的94.12%,乙元素原子电子数比Mg原子核外电子数
少1个,丙单质是一种新型燃料,丁是地壳中含量最多的一种元
素,则:甲_______元素;乙________元素;丙_________元素;
丁________元素.
2.固体A与足量液体B反应生成使石灰水浑浊的气体C和液体D,将
D分成2份,一份加入硝酸银溶液产生白色沉淀,再加稀硝酸白色沉
淀不消失;另一份加入氢氧化钠溶液微热产生使湿的红色石蕊试纸变
蓝的气体.问A、B、C、D各是什么物质?写出上面一系列反应的
化学方程式.
五、实验题
实验室制备的二氧化碳气体中,通常含有氯化氢、水等气体杂质,为了制
得纯净的二氧化碳气体,可将其制备装置设计如下图:
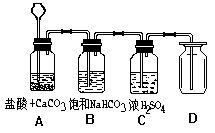
1.A中用盐酸而不用硫酸的原因是:_______________________
2.B装置的作用是除二氧化碳气体中混有的氯化氢气体,其中发生反应的
化学方程式为:________________.
3.C装置的作用是:_________________________.
4.收集二氧化碳,通常采用向上排空气法,这是因为:_________________.
5.判断D中已充满二氧化碳的方法是:________________________.
六、计算题
1.由X、Y、Z各10克组成的混合物,加热使其充分反应,测得反应
后混合物中有16克Z、8克新生物质W和若干克剩余物X,根据质量
守恒定律,(1)剩余物X有多少克?(2)反应物X和Y的质量比是多少?
2.(1)现有5%的硫酸50克,要使其浓度增大到20%,需加95%的
![]()
中加入多少克碳酸钠晶体,恰好反应完,(3)反应后溶液在20℃时有无晶
体析出?(20℃时硫酸钠的溶解度为44克.)(保留2位小数)