初三化学中考模拟试题(五)
相对原子量:H-1 C-12 O-16 Na-23 Ba-137 Cl-35.5 Fe-56 Cu-64 Zn-65 Ca-40 S-32
一、选择题(本题包括15小题,每小题只有1 个选项符合题意,每小题1分,共15分)
1、下列变化中属于物理变化的是 ( )
A、铁变成锈 B、红热的铜丝在空气中变黑 C、大米酿成酒 D、冰融化成水
2、现代信息技术中广泛用到的一种半导体材料,是地壳中含量第二的元素的单质晶体,这种元素是 ( )
A、Si B、N C、Al D、O
3、“绿色化学”的核心内涵是“在反应过程或化工生产中,尽量减少或彻底消除使用和产生有害物质。”下列情况符合绿色化学内涵的是 ( )
A、工厂烟囱冒出黑烟 B、化工厂排出污水 C、农村大量使用农药
D、造纸厂用O2或O3溴氧漂白纸浆
4、某物质只含一种元素,则这种物质 ( )
A、可能是单质或化合物 B、可能是纯净物或混合物
C、一定是纯净物 D、一定是一种单质
5、科学家发现了一种新元素,它的原子核内有111个质子、161个中子,则该元素原子的核外电子数是 ( )
A、50 B、111 C、161 D、272
6、粗盐含有杂质,放上几天就会变潮,这是因为它含有少量的 ( )
A、NaOH B、CaO C、Ca(OH)2 D、MgCl2
7、日常生活中常见的下列物质:①汽油 ② 酒精 ③沼气 ④醋酸 ⑤冰 ⑥淀粉 ⑦石墨,下列组合中全是有机物的是 ( )
A、①②④⑤ B、②③④⑥ C、④⑤⑥⑦ D、①③④⑤
8、德国科学家试用“汽水”(碳酸饮料)浇灌植物,其不能起到的作用是 ( )
A、调节土壤的PH值,减弱土壤的碱性 B、提高农作物的产量
C、促进植物的光合作用 D、加速植物的呼吸作用
9、在水溶液中,一般不跟其它物质发生复分解反应的是 ( )
A、氯化钾 B、硝酸 C、硝酸钠 D、氢氧化钠
10、下列各组中的物质,其有关性质比较结果有错误的是 ( )
A、 标准状况下的密度:CO2>O2>空气 B、通常状况下在水中的溶解度:CO2>O2>H2
C、常压(即1.01×105Pa)下的沸点:N2>O2>H2
D、常温下在水中的溶解度:MgSO4>CaSO4>CaCO3
11、下列关于原子的说法正确的是 ( )
A、构成物质的最小微粒 B、不可再分的微粒
C、保持物质化学性质的微粒 D、化学变化中最小微粒
12、下列实验操作不会使试管炸裂 ( )
A、加热固体物质时,试管口向上倾斜 B、加热时试管的底部触及酒精灯灯芯
C、不使用石棉网而直接给试管加热 D、未经均匀受热就立即固定加热试管
13、微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁和钴的化合价分别为 ( )
A、+2、+3 B、+3、+2 C、+2、+2 D、+3、+3
14、下列各物质中一定含有氢元素的是( )
A、酸性氧化物 B、碱 C、碱性氧化物 D、硫酸盐
![]()
 15、关于微粒结构示意图
和 的下列说法中,正确的是 ( )
15、关于微粒结构示意图
和 的下列说法中,正确的是 ( )
A、它们都属于稳定结构 B、它们都属于金属元素
C、它们都是离子 D、它们表示同一种元素
二、选择题(本题包括5小题,每小题只有1个选项符合题意,每小题2分,共10分)
16、某位同学用托盘天平称量固体药品时,称量前指针未指在分度盘中间,称量时样品放置天平的右盘,天平平衡时用了10g砝码,游码指示0.5g,则药品的真实质量为 ( )
A、9.5g B、10g C、10.5g D、无法确定
17、常温下将10g下列固体与90g水充分混合,所得溶液的质量分数最低的是 ( )
A、胆矾 B、氧化钙 C、氧化钠 D、硝酸钾
18、下列混合物中,能通过“用水溶解、过滤、蒸发”等操作分离的是 ( )
A、氯化钠和硝酸钾 B、氧化铁和氧化铜
C、氯化钾和二氧化锰 D、氯化镁和氧化钙
19、t℃下某物质的饱和溶液降温后有晶体析出,由此得出的下列说法正确的是 ( )
A、溶液变为不饱和溶液 B、溶液中溶质质量分数不变
C、溶剂质量不变 D、该物质的溶解度随温度升高而增大
20、医疗上颇为流行的“理疗特效热 ”,就是利用铁均匀、稳定,使患处保持温热状态,56g铁粉完全氧化,需消耗氧气的质量 ( )
A、16g B、21g C、24g D、32g
三、选择题(本题包括5小题,每小题有1-2个选项符合题意,每题2分,共10分)
21、在无色溶液中,能大量共存的一组离子是 ( )
A、H+ 、Ag+ 、Na+ 、NO3- B、H+ 、Na+ 、Cl- 、NO3-
C、H+ 、Na+ 、Cl- 、CO32- D、Na+ 、Cu2+ 、NO3- 、OH-
22、只能用与酸反应的方法,才能实现下列物质间的一步转化的是 ( )
A、Zn→ZnSO4 B、MgO→MgCl2 C、BaCl2→BaSO4 D、CaCO3→CO2
23、在CO2通过炽热的碳的反应中,下列说法正确的是 ( )
A、CO被氧化,做还原剂 B、C被氧化,做氧化剂
C、CO2被还原,做氧化剂 D、CO被还原,做还原剂
24、下列关于化学反应类型的叙述中,正确的是 ( )
A、凡是生成盐和水的反应都是中和反应 B、复分解反应一定没有单质参加
C、生成一种单质和一种化合物的反应一定是置换反应
B、 分解反应的生成物不一定是单质
 25、如图所示,在杠杆的两端分别挂着质量相同的铁球和锌球,这时杠杆平衡,然而将两球分别浸没在稀H2SO4和CuSO4溶液中片刻,
25、如图所示,在杠杆的两端分别挂着质量相同的铁球和锌球,这时杠杆平衡,然而将两球分别浸没在稀H2SO4和CuSO4溶液中片刻,
下列说法中正确的是 ( )
A、左边烧杯中溶液的质量增加
B、右边烧杯中溶液的质量减少
C、两边烧杯中溶液的质量都不变
D、取掉烧杯后,杠杆仍然保持平衡
四、填空题(本题包括10小题,共30分)
26、(6分)有下列几种物质:A、盐酸 B、硫酸 C、熟石灰 D、硫酸铜 E、纯碱 F、食盐,请选择合适物质用化学式填空。(物质不得重复使用)
(1) 用来清除铁锈的物质是__________
(2) 能中和土酸性,改良土壤结构的物质是__________
(3) 在日常生活中用作调味剂和防腐剂的物质是__________
(4) 存在于人的胃液中可帮助消化的物质是__________
(5) 工业上制造各种铜的化合物时,用到的物质是__________
(6) 做馒头时,除去面团发酵生成的酸选用的物质是__________
27、(2分) TNT是一种烈性炸药,它爆炸时发生如下的化学反应:
TNT+21O2 点燃 28CO2+10H2O+6N2
则组成TNT的元素分别是__________,其原子个数比为__________。
28、(1分) 三硝酸甘油酯[C3H5(ONO2)3]是一种炸药,撞击后发生爆炸,反应的化学方程式为:
4C3H5(ONO2)3=wN2+xCO2+yH2O+zO2 计量数x、y之和为____________________。
 29、(1分)金属钛(Ti)的氧化物二氧化钛(TiO2)是优良的白色颜料,常用于制作高档油漆,四氯化钛是一种无色液体,非常容易跟空气中的水发生反应生成二氧化钛,并有大量酸雾生成,写出四氯化钛跟水反应的化学方程式_____________________________________。
29、(1分)金属钛(Ti)的氧化物二氧化钛(TiO2)是优良的白色颜料,常用于制作高档油漆,四氯化钛是一种无色液体,非常容易跟空气中的水发生反应生成二氧化钛,并有大量酸雾生成,写出四氯化钛跟水反应的化学方程式_____________________________________。
30、(2分)右图中,H是一种汽车安全气囊,内部贮有硝酸铵,当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解,产生大量一氧化二氮气体和另一种氧化物,充满所囊,填补在乘员与挡风玻璃、方向盘之间,防止乘员受伤。
(1)硝酸铵受撞击后发生分解反应的化学方程式是:
_________________________________________
(2)此反应中氮元素的化合价不可能是( )
 A、-3价 B、+1价 C、+3价 D、+5价
A、-3价 B、+1价 C、+3价 D、+5价
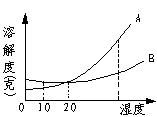
31、(3分)A、B两种物质的溶解度曲线如右图所示。
(1)在_____℃时,A、B两物质饱和溶液中溶质质量分数相等。
(2)在高于20℃时,物质的溶解度A_____B(填>、=、<)。
(3)当A中含有少量B时,可以用_________法提纯A。
32、(4分)被称为“绿色氧化剂”的过氧化氢(H2O2),俗称双氧水,
是一种无色的液体,常用作氧化剂、消毒杀菌剂、漂白剂等。在较低温度和少量催化剂(如MnO2)条件下,它能迅速分解,生成氧气和水。问:
(1)过氧化氢分解反应的化学方程式是_______________________________。
![]() (2)若在实验室用过氧化氢代替氯酸钾制取氧气,可采用实验室制取__________气体的反应装置,主要理由是_____________________________________________。
(2)若在实验室用过氧化氢代替氯酸钾制取氧气,可采用实验室制取__________气体的反应装置,主要理由是_____________________________________________。
 33、(4分)
按左图所示的装置打开分液漏斗的活塞,让水滴入锥形瓶中,可以看到锥形瓶中出现_________________、______________________的现象,同时U形管中______________________。这个事实告诉我们:为了防止发生事故在稀释浓硫酸时,一定要将_____________________________________________。
33、(4分)
按左图所示的装置打开分液漏斗的活塞,让水滴入锥形瓶中,可以看到锥形瓶中出现_________________、______________________的现象,同时U形管中______________________。这个事实告诉我们:为了防止发生事故在稀释浓硫酸时,一定要将_____________________________________________。
34、(5分)我们已经知道空气的主要成分是氮气和氧气,下图为测定空气中氧气含量的示意图。
 (1)实验时,燃烧匙里为什么要盛过量的红磷?_______________
(1)实验时,燃烧匙里为什么要盛过量的红磷?_______________
__________________________________________________________。
(2)这个实验除了可以得出氧气约占空气体积1/5的结论外,还可以得出有关氮气性质的哪些结论?
________________________________________________________
_________________________________________________________。
(3)如何证明生成的白色固体溶于水后的溶液呈酸性?___________________________
___________________________________________________________________________
35、(2分)在常温下,由A和B两种气体组成的混合气体(A的式量大于B的式量)中只含有碳和氧两种元素,且A和B不论以何种比例混合,氧和碳的质量比均大于8∶3。
A为___________________________,B为_________________________(写化学式)。
五、简答题(本题包括2小题,共5分)
36、(2分)某学生用盐酸和大理石反应制取CO2,并把制得气体通入澄清石灰水中,石灰水却没有预期那样变浑。试分析产生这一现象的主要原因。(2点)
37、(3分)为探索物质在化学变化前后的质量关系,科学家做了大量实验。1673年,英国物理学家波义耳做了一个有名的实验,他将金属放在密闭窗口里煅烧,煅烧后他立即打开容器进行称量,结果发现反应后的固体质量增加了,该实验导致波义耳未能发现质量守恒定律,请你简要分析一下原因是什么?
六、实验推断题(本题包括3小题,共19分)
38、(6分)草酸(H2C2O4)是一种无色固体,它在加热条件下易分解,反应方程式为:
H2C2O4 △ CO↑ + CO2↑ + H2O
现在实验室用下图所示装置组装成一套连接装置,用来加热草酸获得混合气体,在除去CO2、水蒸气后,再用纯净的CO还原氧化铜,并检验还原CuO后的气体产物。(其中A为加热草酸获得气体的装置,装置图未画出)
(1)装置正确的连接顺序是(在方框中填接口代号):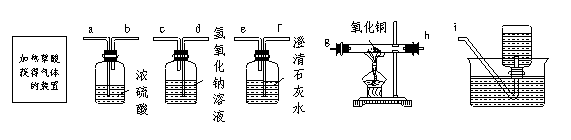
A B C D E F
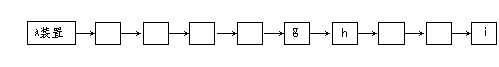
(2)装置C的作用是___________________________________________,
其中反应的化学方程式为____________________________________________。
(3)装置F的作用是___________________________________________,
要达到与F装置同样的目的,还可采用的方法是___________________________。
(4)从下列提供的仪器中选出A装置所用到的仪器__________(填仪器编号)。
① 试管 ②烧杯 ③蒸发皿 ④酒精灯 ⑤铁架台(带铁夹) ⑥带导管的橡皮塞
39、(4分)有一包白色粉末可能为CaCO3、K2SO4、NaNO3、CuSO4、BaCl2的一种或几种组成,做实验得出以下实验报告,请将实验报告补充完整。
| 实验步骤 | ⑴ 将此固体加到水中 | ⑵ 向①过滤后得到的白色沉淀加入稀HNO3出现②③④三种情况,请分三种情况讨论 | ||||
| 实验现象 | ① 得到白色沉淀,上层清液呈蓝色 | ② 若沉淀全部溶解 | ③ 若沉淀不溶解 | ④ 若沉淀部分溶解 | ||
| 实验结论 | 该粉末一定有_______ |
| 该粉末中可能含有________ | 该粉末中一定含有________ | ||
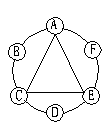 40、(9分)有A、B、C、D、E、F 6种物质,它们的相互关系如右图所示(连线表示能相互反应)。已知:D是一种金属单质,它可能是锌或铜;A、B、C、D、E、F分别是AgNO3,Ca(OH)2,盐酸,Na2CO3,BaCl2 5种物质中的一种。其中,A和C反应时能生成一种无色气体。
40、(9分)有A、B、C、D、E、F 6种物质,它们的相互关系如右图所示(连线表示能相互反应)。已知:D是一种金属单质,它可能是锌或铜;A、B、C、D、E、F分别是AgNO3,Ca(OH)2,盐酸,Na2CO3,BaCl2 5种物质中的一种。其中,A和C反应时能生成一种无色气体。
⑴它们的化学式分别是
A、__________________________________________
B、__________________________________________
C、__________________________________________
D、__________________________________________
E、__________________________________________
F、__________________________________________
⑵写出有关化学反应的方程式
A+B_____________________________ D+E________________________________
⑶写出F在水溶液的电离方程式______________________________________________
七、计算题(本题包括2小题,共11分)
41、(5分)将3.6g碳酸钙高温煅烧一段时间后,冷却,测得固体剩余物中钙元素的质量分数为57.6%,计算固体剩余物中氧化钙的质量。
42、(6分)在100g质量分数为10.6%的Na2CO3溶液中加入足量的BaCl2溶液,问:
(1) 生成的沉淀是多少克?
要使生成的沉淀全部溶解,至少要加入质量分数为14.6%的盐酸多少?
答 案
一、二、三选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| D | A | D | B | B | D | B | D | C | C | D | C | B | B | A | D | B | C | D | C | AB | B | C | BD | A |
四、填空题
26、⑴H2SO4 ⑵Ca(OH)2 ⑶NaCl ⑷HCl ⑸CuSO4 ⑹NaCO3
27、C、H、O、N 28∶20∶24∶12(7∶5∶6∶3)
28、x+y=22
29、TiCl4+2H2O TiO2+4HCl
30、⑴NH4NO3 撞击 N2O+2H2O ⑵C
31、⑴20℃ ⑵ > ⑶降温结晶(冷却饱和溶液结晶)
32、⑴2H2O2 MnO2 2H2O + O2↑
⑵H2或CO2;双氧水和二氧化锰的状态分别为液态和固态,且不需加热
33、液滴飞溅;水浮在硫酸上面,甲管水面下降,乙管水面上升;浓硫酸沿着器壁慢慢地注入水中
34、⑴红磷过量才能将空气中的氧气消耗完全,测出的氧气体积才更接近空气中氧气的实际体(1分);⑵难溶于水,化学性质不活泼(2分);⑶将燃烧匙中的白色固体加入一试管中,滴加紫色石蕊试液,石蕊试液为红色(2分)
35、CO2 O2 36、⑴盐酸浓度过大 ⑵气密性未检查 ⑶药品用量不足
37、由于金属在煅烧时会结合空气中的氧气波义耳在煅烧后打开容器盖进行称量,使外界的空气进入容器,所以反应后的固体质量增加,导致波义耳未能发现质量守恒定律。
38、⑴A装置→d→c→a→b→g→h→f→e→i (接错一个就不给分)
⑵除去CO2 CO2 + 2NaOH = Na2CO3 + H2O
⑶收集尾气,防止CO污染环境 点燃(或用气球、塑料袋收集等)⑷①④⑤⑥
39、CuSO4;BaCl2;K2SO4;CaCO3;BaCl2
40、⑴A:Na2CO3 B:Ca(OH)2 C:HCl D:Zn E:AgNO3 F:BaCl2
⑵Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH Zn + 2AgNO3=Zn(NO3)2 + 2Ag
⑶BaCl2=Ba2++2Cl-
41、解:设:剩余固体质量为x 42、解:设:生成BaCO3质量为x,盐酸质量为y
3.6g× =x·57.6% x=2.5g(1分) Na2CO3 + BaCl2=BaCO3↓+2NaCl
又设:固体剩余物中CaO质量为y BaCO3 + 2HCl=BaCl2 +CO2↑+ H2O
CaCO3 高温 CaO + CO2↑(1分) Na2CO3 ~ BaCO3 ~ 2HCl
56 44 106 197 73
y 3.6g-2.5g (1分) 100g×10.6% x y×14.6%
56∶44=y∶1.1g
![]()
y=1.4g (1分) x=19.7g (1分) y=50.0g (1分)
答:略(解、设、答共1分) 答:略 (解、设、答共1分)