初三化学中考模拟试题(九)
试卷说明:1.考试时间100分钟,试卷满分100分。
2.可能用到的原子量:H-1 N-14 O-16 Ca-40 S-32 Cu-64。
一、选择题(本题包括20小题,每小题2分,共40分,每小题只有1个正确答案)
1.下列现象属于物质变化的是( )
A.拖拉机旁闻到柴油味 B.农家肥料发酵
C.农机具锈蚀 D.柴草垛底潮湿腐烂
2.下列各组物质中,都可溶于水的一组是( )
A.Fe(OH)3,KOH B.Ba(NO3)2,CaCO3
C.MgSO4,K2CO3 D.CaO,Fe2O3
3.下列关于一些物质的用途的说法中,错误的是( )
A.干冰可用于人工降雨 B.用纯铁制成的机械和刀具性能优良
C.稀硫酸可用来清除铁器表同的锈 D.75%的酒精在医疗上常做消毒剂
4.吸烟有害健康,原因之一是烟气中含有使血红蛋白不能很好地跟氧气结合的有毒气
体,该气体是( )
A.CO B.H2 C.CO2 D.N2
5.为除去热水瓶胆壁上的水垢(主要成分之一是碳酸钙),应加入适量的( )
A.酚酞试液 B.稀盐酸
C.氯化钙溶液 D.石蕊试液
6.对过氧化氢(H2O2)组成的叙述中,正确的是( )
A.由1个氢分子和1个氧分子组成 B.由氢、氧两种元素组成
C由1个水分子和1个氧原子结合而成 D.由两个氢元素和两个氧元素组成
7.下列关于分子、原子、离子的说法,不正确的是( )
A.分子是保持物质性质的一种微粒 B.原子失去电子就变成阳离子
C.原子是构成物质的一种微粒 D.在化学反应中原子不可以再分
8.某村使用的氮肥是含有杂质的硝酸铵,含氮量为38%。这种氮肥中能含有的杂质是
A.NH4HCO3(18%) B.NH2Cl(26%)
C.CO(NH2)2(47%) D.(NH4)2SO4(21%)
9.有关酸、碱、盐组成的说法,错误的是( )
A.酸根中可能含氧元素 B.碱中一定含氢、氧元素
C.正盐中一定不含氢元素 D.酸式盐中含氢元素
10.下面关于“2”的含义的解释中,正确的是( )
A.Mg2+中的“2”表示镁离子带2个单位的正电荷
B.H2O中的“2”表示水分子中有2个氢原子
C.H2SO4中的“2”表示1个硫酸分子中含有2个氢原子
D. Al2(![]() )3中O上面的“2”表示3个硫酸根的化合价为-2价
)3中O上面的“2”表示3个硫酸根的化合价为-2价
11.通过下列变化,肯定不能得到单质的是( )
①分解反应; ②化合反应; ③置换反应; ④复分解反应。
A.② ④ B.③ ④ C. ① ② D.② ③
12. 对人类生存环境不会造成污染的是( )
A.煤的燃烧 B.生活用水的任意排放
C.用氢气做高能燃烧 D.农药、化肥的任意施用
13.尿素[CO(NH2)2]是一种高效化肥,它属于( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
14.下列有关溶液的叙述中,正确的是( )
A.溶液都是无色的 B.溶液都是混合物
C.固态物质溶解度都随温度升高而增大 D.饱和溶液一定是浓溶液
15.下列属于酸的电离方程式的是( )
A.KNO3=K++![]() B.NaCl=Na++Cl-
B.NaCl=Na++Cl-
C.H2SO4=![]() D.NaOH=Na++OH-
D.NaOH=Na++OH-
16.判断复分解反应能否发生,不必考虑的是( )
A.是否有沉淀生成 B.是否有气本生成
C.是否有水生成 D.金属活动性
![]() 17.在C+2CuO 2Cu+CO2↑的反应中,氧化剂是( )
17.在C+2CuO 2Cu+CO2↑的反应中,氧化剂是( )
A.C B.CuO C.Cu D.CO2
18.已知20℃时NaCl的溶解度为36克,20℃时在50克水里最多能溶解NaCl( )
A.18克 B.36克 C.50克 D.100克
19.下列有关实验操作先后顺序的叙述中,错误的是( )
A.先检查装置气密性再装药品
B.制取O2结束时,先将导管移出水面再熄灭酒精灯
C.点燃H2前必须先检验H2的纯度
D.H2还原CuO完毕,先停止通H2再熄灭酒精灯
20.下列实验的操作与方法中,正确的是( )
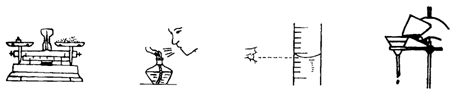
二、选择题(本题包括5小题,每题2分,共10分,每题有1~2个正确答案)
21.下列观点中你不赞成的是( )
A.煤为人类提供能源和化工原料的同时,也埋下了祸根
B.氢气让人欢喜让人忧
C.煤气化能提高市民的生活质量,同时也是个潜伏着的无形杀手
D.水是取之不尽的,只有个别地区存在着用水危机
22.下面一些报道中,你认为科学的是( )
A.疏通煤气管道时,充入氮气引起爆炸
B.新粉刷过石灰浆的墙壁释放出CO2,使一老人窒息而死
C.有易燃易爆物的工作场所,严禁穿化纤类衣服
D.本饮品纯天然,绝对不含化学物质
23.向工厂排出的一种澄清废液中加入BaCl2溶液,产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解并放出能使澄清石灰水变浑浊的气体,下列说法中正确的是( )
A.废液中一定有Ag+
B.废液中一定有![]()
C.废液中一定有![]() D.废液中有H2SO4
D.废液中有H2SO4
 |
24.下列括号内的气体是需要检验的杂质,检验方法中不对的是( )
![]() 25.为了测定某硫酸钙晶体CaSO4·xH2O中的x值,做下列实验:将含结晶水的硫酸钙晶体放在坩埚中加热,至不再含结晶水。反应的方程式为
25.为了测定某硫酸钙晶体CaSO4·xH2O中的x值,做下列实验:将含结晶水的硫酸钙晶体放在坩埚中加热,至不再含结晶水。反应的方程式为
。测得的数据见右表所示。根据测得的数据,得x值为( )
A.1 B.2 C.3 D.5
三、 填空题(共30分)
26.(4分)写出下列物质的化学式:硫酸 ;高锰酸钾 ;乙醇
;碱式碳酸铜 。
27.(2分)书写化学方程式必须遵守的两个原则是:① ;
② 。
28.(2分)溶液pH值越小,酸性越 (填“强”或“弱”)。当溶液pH=10时,加入紫色石蕊试液后,溶液呈 色。
29.(2分)将锌粒和银片分别装入两支试管中,并同时加入质量分数相同的硫酸铜溶液,可观察到的现象是 。由此可知:锌、银、铜的活动性由弱到强的顺序是 。
30.(4分)在初中化学课本里学过的化合物中,常温下属于气体的有 、 、
(写化学式)。二氧化碳可用于灭火是由于 。
31.(5分)某同学使用小试管用向下排空气法收集氢气来检验其纯度。第一次检验时,发现氢气不纯,接着进行第二次检验,第二次检验的操作步骤应为:① ,
② ,③ 。实验室做稀硫酸与氧化铜反应的实验时,所用到的仪器有 。
32.(6分)有一瓶无色透明溶液,其溶质BaCl2、Na2CO3、Ca(OH)2、AgNO3、Na2SO4中的一种。取少量该溶液于试管中,加入Ba(NO3)2溶液后,有白色沉淀生成。
(1)从上述实验现象中能否确定该溶质是哪一种物质?(填“能”或“不能”) 。
(2)向上述试管中继续加入稀盐酸,可能会发生什么现象?因此可得出什么结论?
。
(3)写出可能发生的反应的化学方程式: ; ;
。
33.(5分)在下列物质转化关系中,A,B,C,D,E,F,G,H以及蓝色沉淀都是初中化学课本中学过的物质。在通常情况下,A、B、G是黑色固体。A、C、D、H是单质,F是硫酸盐,C在氧气中燃烧可生成B,反应①②③④都属于置换反应。A与B反应除生成C外,还生成一种能使澄清石灰水变浑浊的气体。
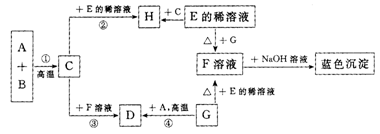
(1)写出下列物质的化学式:C ,G 。
(2)写出上述转化关系中下列反应的化学方程式,并指出E和G反应的反应类型(置换、化合、分解、复分解)
A+B 。E+G: ,属 反应。
四、 实验题(共10分)
34.下图是实验室制取气体的装置图:

根据图示回答:
(1)写出标号仪器的名称:
a. ;b. ;c. ;d. ;e. .
(2)用装置图编号(A或B)填空:制取氧气应使用 装置,制取氢气应使用
装置。
(3)制取氧气实验完毕后,应先 ,后 。点燃氢气前必须检验氢气的 。
五、计算题(本题包括2小题,共10分)
35.(5分)铜粉和氧化铜的混合物55克,与一定量的20%的稀硫酸完全反应后过滤,得到345克滤液。将所得滤液降温至t℃时有25克CuSO4·5H2O晶体析出。求原混合物中氧化铜的质量。(t℃时滤液中溶质的溶解度为25克)
36.(5分)已知氢气不仅可以在氧气中燃烧生成水,也可在氯气中燃烧生成氯化氢。今在一密闭容器中通入氢气、氧气、氯气3种气体,用电火花点燃使它们充分燃烧,反应后3种气体均无剩余,冷却后得到一种酸溶液,其溶质的质量分数为28.9%。
求原混合气体中3种气体的分子个数比。(提示:除不尽时保留两位小数)
初三化学中考模拟试题(九)参考答案
一、1.A 2.C 3.B 4.A 5.B 6.B 7.A 8.C 9.C 10.C 11.A 12.C 13.A
14.B 15.C 16.D 17.B 18.A 19.D 20.C
二、21.D 22.C 23.B、C 24.B 25.B
三、26.H2SO4,KmnO4,C2H5OH,Cu2(OH)2CO3
27.必须以客观事实为基础,必须遵守质量恒定律
28.强,红
29.盛锌粒的试管中,锌粒表面覆盖一层红色的物质,溶液的蓝色逐渐变浅,盛银片的试管内无变化。银<铜<锌
30.CO2,CO,CH4。二氧化碳不能燃烧,不能支持燃烧,密度比空气大
31.①用拇指堵住试管口一会儿(或换一支试管) ②再收集一试管氢气(或收集氢气),用拇指堵住管口,移近火焰 ③移开拇指点火(或检验)。试管、药匙、试管夹、酒精灯、纸槽
32.(1)不能 (2)沉淀可能溶解并产生大量气泡,说明原溶液为Na2CO3溶液;也可能无明显变化产生,说明原溶液为Na2SO4溶液
(3)Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3,Na2SO4+Ba(NO3)2=BaSO4↓2NaNO3,
![]() BaCO3+2HCl=BaCl2+CO2↑+H2O
BaCO3+2HCl=BaCl2+CO2↑+H2O
33.(1)Fe,CuO (2)2C+Fe3O4 3Fe+2CO2↑,CuO+H2SO4=CuSO4+H2O,复分解
四、34.(1)a.铁架台 b.水槽 c.酒精灯 d.试管 e.集气瓶
(2)B,A
(3)从水槽中移出导管,撤酒精灯,纯度
五、35.CuSO4·5H2O中含有CuSO4:25克×![]() (345-25)克
(345-25)克
![]()
设原混合物中CuO的质量为x克,根据CuO+H2SO4=CuSO4+H2O列比例式,解得
![]() 。
。
36.根据所得酸溶液的溶质的质量分数可知:
![]()
H、O、Cl原子个数比=(1+2×5):5:1=11:5:1.由于氢气、氧气、氯气都是双原子分子,所以原混合气体中H2、O2、Cl2的分子个数之比为:11:5:1。