相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5
K:39 Ca:40 Mn:55 Fe:56 Cu:64 Zn:65 Ag:108 Ba:137
第I卷(选择题)
一.选择题(本题共15分)每题只有一个正确答案,将其正确的标号填在下表中。每小题1分。
1.下列变化,属于化学变化的是
A.蜡烛熔化 B.空气液化制氧气
C.铜器在潮湿的空气中产生铜绿 D.利用干冰进行人工降雨
2.下列粒子中,能保持氢气化学性质的是

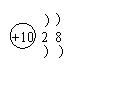 A.H B.H+ C.H2 D.H2O
A.H B.H+ C.H2 D.H2O
3.下列各组粒子中,属于同一种元素的是
A.Cl和Cl- B. CO2和CO C. H和He D. 和
4.从物质分类的角度看,冰水混合物属于
A.有机物 B.氧化物 C.单质 D.混合物
5.有下列情况:①煤的燃烧 ②氢气的燃烧 ③工业废气的任意排放 ④汽车、飞机尾气的排放 ⑤燃放鞭炮 ⑥绿色植物进行光合作用,其中不会造成空气污染的是
A.④⑤ B.②⑥ C.①③ D.⑤⑥
6.化学反应2H2O2(过氧化氢) 2H2O+O2↑的反应事实,说明了
A.过氧化氢分子在化学反应中可以再分
B.化学反应前后分子的总数不变
C.过氧化氢是由水和氧气组成的
D.在化学反应中原子可以再分
7.下列实验操作中,正确的是
A.熄灭酒精灯时,用嘴去吹
B.称量药品时,用镊子夹取砝码
C.反应中没有用完的药品,放回原试剂瓶中
![]()
8.下列化学反应方程式书写正确的是
![]()
![]() A.2Fe+3H2SO4=Fe2(SO4)3+3H2↑
A.2Fe+3H2SO4=Fe2(SO4)3+3H2↑
![]() B.Mg+O2 MgO2
B.Mg+O2 MgO2
C.C+2CuO 2Cu+CO2↑
D.Fe2O3+2CO 2Fe+2CO2
9.香港兴建赤鱲角1248公倾新机场,是一个开山填海的庞大工程,共使用烈性炸药“TNT”5600吨。TNT炸药爆炸是时发生如下反应:21O2+4TNT=28CO2+10H2O+6N2则“TNT”的化学式是
A. C7H5N3O6 B. C7H5N3O4 C. C5H3NO6 D. C7H5NO6
10.鲨鱼是世界上唯一不患癌症的动物,研究发现其体内含有的角鲨烯(C30H50)有抗癌作用。有关角鲨烯的组成或构成的叙述正确的是
①角鲨烯是由碳、氢两种元素组成的;②角鲨烯是由角鲨烯分子构成的;③角鲨烯的相对分子质量为410;④角鲨烯中含氢元素的质量分数约为12.2%;⑤角鲨烯分子中碳原子和氢原子的个数比为3:5
A.①②③④⑤ B. ②③④⑤ C. ①② D. ①②⑤
11.下列叙述正确的是
A.物质的水溶液一定是无色透明的
B.饱和溶液是纯净物,不饱和溶液是混合物
C.当饱和溶液的温度升高时,其溶质的溶解度一定变大
D.饱和溶液不一定比不饱和溶液中溶质的质量分数大
12.下列与铁有关的叙述中错误的是
A.生铁的含碳量低于钢
B.为防止钢铁表面生锈,通常要保持其表面的洁净、干燥或涂上保护膜
C.铁跟氧气在点燃的条件下生成黑色的四氧化三铁固体
D.铁与硫酸铜溶液反应,可置换出铜
13.鉴别O2、H2、CO2三瓶无色气体,最简便的方法是
A.通入澄清石灰水 B.将燃着的木条伸入集气瓶
C.测定气体的溶解性 D.分别通过加热的木炭粉
14.一种无色气体A和固体B充分反应得到另一种气体C,C与B反应得到D,D与加热的氧化铜反应又得到C。根据上述变化判断A、B、C、D四种物质依次是
A.O2、C、CO、CO2 B.O2、C、CO2、CO
C.CO、C、CO2、O2 D.CO2、CO、C、O2
15.2.8g一氧化碳在高温下跟5.8g某种铁的氧化物恰好完全反应,这种氧化物是
A. FeO B. Fe2O3 C. Fe3O4 D. 不能确定
二.选择题(本题共20分)每题有1~2个正确答案,将其标号填在下表中。每题2分,正确答案只有一个的,多选不给分;正确答案包括两个选项的只选一个且正确给1分,一对一错不给分。
16.纳米材料被誉为21世纪最有前途的新型材料,许多材料达到纳米(1纳米=10-9米)级的大小时,会产生许多让你料想不到的、奇特的光、电、磁、热、力和化学等方面的性质。如:将金属制成纳米粉末后就变成了黑色,且不导电,机械强度也大幅度提高。由此你判断下列说法错误的是
A.纳米碳质地很柔软,构成其的基本粒子是碳原子
B.纳米氧化锌能吸收电磁波
C.黑色的氧化铜粉末属于纳米材料
D.若将银白色铁通过特殊加工成纳米粉末,其物理性质将发生一定的变化
17.对于化学反应A+B→C+D的下列说法中,正确的是
A.若A、B分别为单质和化合物,C、D也分别为单质和化合物,则该反应一定
是置换反应
B.若生成的C、D的质量和为20g,则参加该反应的A和B的质量和一定是20g
C.若A、B都是化合物,则C、D也一定都是化合物
D.若C和D两物质中有一种物质为Cu,则A和B两物质中必有一种物质为CuO
18.对于化学反应aX+bY=cM+dN(X、Y、M、N表示反应物和生成物的化学式a、b、c、d为化学计量数),下列说法不正确的是
A.a+b不一定等于c+d
B.X和Y的分子数之和一定等于M和N的分子数之和
C.反应物X和Y中所含的原子个数之和一定等于生成物M和N中所含的原子
数之和
D.X和Y所含的元素种类一定与M和N所含的元素种类相同
19.要将50g质量分数为a%的某溶液变为2a%(溶解度允许值内),可采用的方法有
A.蒸发掉一半溶剂(恒温)
B.蒸发掉25g溶剂(恒温)
C.再加入50a%g的该溶液
![]()
20.某一密闭容器中盛有H2、O2的混合气体共10g,经电火花点燃充分反应后,测得生成水的质量为9g,则原混合气体中H2和O2的质量比可能为
A.1:8 B. 1:4 C. 2:7 D. 1:9
21.将3g某物质在氧气中完全燃烧,产物为8.8g二氧化碳和5.4g水,根据此事实,判断该物质中
A.一定含有碳、氢两种元素 B. 一定不含氧元素
C.可能含有氧元素 D. 氢元素的质量分数为10%
22.对下列实验中所用的试剂或方法中,你认为错误的是
A.用煅烧的方法除去CaO中少量的CaCO3
B.检验H2中少量的CO2可以通过足量的石灰石
C.向混有少量CuSO4的FeSO4溶液加入足量的铁粉可以除去CuSO4
D.检验CO2中是否有少量CO,可先除尽CO2,再通过灼热的CuO,最后通过澄
清石灰水
23.若将KClO3和MnO2的均匀混合物14g加热,待完全反应后得到9.2g固体物质,另取该混合物21g,加热一段时间后,测得所剩固体中MnO2的质量分数为15%,根据质量守恒定律判断生成O2的质量是
A.7.2g B. 11.8g C. 3.5g D. 9.6g
24.在天平的两个托盘上各放一只烧杯,烧杯中都盛有足量的盐酸,此时天平保持平衡。如果一边投入少许锌粒,另一边投入相同质量的铁粉,两者都完全溶解后,天平指针将
A.偏向放锌粒的烧杯一边 B. 不发生偏转
C.偏向放铁粉的烧杯一边 D. 无法判断
25.右图是A、B两种固体物质的溶解度曲线,下列说法中正确的是
A.A物质的溶解度大于B物质的溶解度
B.t10C时,A、B两种物质的溶解度相等
C.t20C时,A、B两种物质的饱和溶液中溶质的质量分数相等
D.A、B两种物质的溶液各100g,由t20C时降到t10C时,B析出的晶体可能比
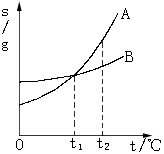 A多
A多
第II卷(非选择题)
三.填空题(本题共28分)
26.(4分)(1)金刚石与石墨都是由碳元素组成的单质,但它们的物理性质有很大的差异,其原因是__________________________;
(2)将几块烘烤过的木炭投入到滴有少量红墨水的水中,振荡后可观察到________;这是因为木炭具有________能力;
(3)当今世界上最重要的三大化石燃料是____________________________;
(4)在一切化学反应里,反应前后原子的________没有改变,原子________也没有增减,原子的质量也没有改变,所以化学反应前后各物质的质量总和必然相等。
27.(4分)(1)根据下表所给的原子结构示意图,回答有关内容(元素类别是指金属元素、非金属元素、稀有气体元素)。
|
| 核电荷数 | 电子层数 | 最外层电子数 | 元素类别 |
(2)用化学符号表示:
2个氮原子________;3个水分子________;
2个硫酸根离子________;正二价的钙元素________。
28.(4分)如果血液中缺乏Fe2+离子,就会造成缺铁性贫血。市场上出售的某中草药片中含有微量的极细小的铁粉。这些铁粉在人体胃液(胃液的主要成分是HCl)作用下生成Fe2+。该反应的化学方程式是________________。胃酸过多的患者,服用含碳酸钠的药剂后,胃液胃酸将会减少,其原理可用化学方程式表示为________________.
29.(8分)填写有关的化学方程式,并简答该反应的有关内容.
| 化学反应 | 化学方程式 | 简答 |
| 水在通电条件下的反应 | 反应的基本类型_______ | |
| 硫在氧气中燃烧 | 反应现象_______ | |
| 加热氯酸钾和二氧化锰的混合物 | 二氧化锰是_______剂 | |
| 氢气与氧化铜在加热条件下的反应 | 氢气具有_______性 |
30.(2分)一定质量的5%的NaOH溶液,加热蒸发掉120g水后变成密度为1.25g/cm312.5%的溶液。则原溶液的质量为_______克,剩余溶液的体积为_______毫升。
31.(2分)化学中最常见的氮肥是尿素[CO(NH2)2]和碳铵(NH4HCO3)。碳铵中氮元素的质量分数_______;20kg尿素与_______千克碳铵中所含的氮元素的质量相等。
32.(2分)CO和CO2的混合气体10g与足量灼热的氧化铜反应后,测得质量比原来增加4g,则原混合气体中CO和CO2的质量比为_______。
33.(2分)有A、B、C三种物质各4g组成的混合物,在一定条件下发生反应,反应后的物质中仅有5gA、5gD和若干克B,根据质量守恒定律,可知参加反应的物质的质量比为_______。
四.简答题(本题26分)
34.(8分)用C、CO、CuO、CaCO3、盐酸五种物质,可进行单一或两两反应生成CO2。试写出能生成CO2的化学反应方程式_______________________________________________
_________________________________________________。
35.(6分)A、B、C、D、E、F六种物质,A、F是黑色粉末状固体;B是有剧毒的无色气体;D是一种金属,它在地壳中的含量仅次于铝。这六种物质间相互转化关系如右图,试推断它们各是什么物质?写出它们的化学式:
A_______;B_______;C_______;D_______;E_______;F_______。
 |
36.(6分)铁盒罐头过期会出现“胖听”现象(内部产生大量气体,底和盖向外鼓胀),一般分为两类:(1)化学性“胖听”:一般是铁皮与罐内酸性物质反应产生气体。(2)生物性“胖听”:一般是罐内物质腐败所致。用金属针头钉入罐头内,将气体导出进行如下实验,请填写下列实验报告:
| 实验内容 | 实验现象 | 化学方程式 | 属于何种“胖听” |
| (1)点燃导出气体罩上玻璃杯_____ | 玻璃杯内壁有 _____出现 | ||
| (2)导出气体通入澄清的石灰水中 | 石灰水_____ |
37.(6分)下图是某同学设计的实验装置图,用文字回答下列问题。
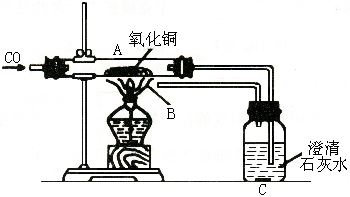 |
(1)在给CuO加热前,要先通入一氧化碳,其目的是_________________________;
(2)实验进行时,在A处看到的现象是_______________________________________,说明________________________________________。
(3)C处看到的现象是__________,说明_______________;
(4)本实验设计中,在B处所采取措施的目的是____________________。
五.计算题(本题共11分)
38.(4分)将6g含杂质的铁屑溶于足量的稀硫酸中,共生成0.2g氢气(杂质不与酸反应)。计算:
(1)铁屑中铁的质量分数是多少?(结果保留0.1%)
(2)反应能产生多少克硫酸亚铁?
39.(7分)在实验室中制取2.2g二氧化碳气体(标准状况下二氧化碳的密度为1.977g/L)。计算:
(1)所制取的二氧化碳在标准状况下的体积为多少升?(结果保留0.01)
(2)需要多少克碳酸钙与适量盐酸反应?
(3)若改用含杂质20%的石灰石与50g盐酸恰好完全反应(杂质不与盐酸反应),则盐酸溶液溶质的质量分数为多少?
和平区2002-2003学年度第一学期九年级化学学科质量调查试卷A卷参考答案
本答案是为统一阅卷制定的,学生的合理答案可参照此标准给分。
一.选择题(本题共15分,每小题1分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | C | C | A | B | B | A | B | C | A | A | D | A | B | B | C |
二.选择题(本题共20分,每题2分)
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 答案 | C | AB | B | BD | BD | AB | B | C | A | BD |
三.填空题(本题共28分)
26.(共4分)
(1)碳原子的排列方式不同(1分) (2)红墨水褪色(0.5分);吸附(0.5分)
(3)煤、石油、天然气(1分) (4)种类;(0.5分) 数目(0.5分)
27.(共4分)
(1)(每空0.5分,共2分)
| 原子结构示意图 | 核电荷数 | 电子层数 | 最外层电子数 | 元素类别 |
| 8 | 2 | 6 | 非金属元素 |
|
28.(共4分)Fe+2HCl=FeCl2+H2↑(2分);Na2CO3+2HCl=2NaCl+H2O+CO2↑(2分)
29.(每空1分,共8分)
| 化学反应 | 化学方程式 | 简答 |
|
| 2H2O 2H2↑+O2↑ | 分解反应 |
|
| S+O2 SO2 | 蓝紫色火焰,有刺激性气味气体产生 |
| 2KClO3 2KCl+3O2↑ | 催化 | |
|
| H2+CuO Cu+H2O | 还原 |
30.(共2分)200(1分);64(1分)
31.(共2分)17.72%(1分);52.67(1分)
32.(共2分)7:3(2分)
33.(共2分)1:2(或2:1)(2分)
四.简答题(共26分)
![]()
![]() 34.(每个方程式2分,共8分)
34.(每个方程式2分,共8分)
C+2CuO 2Cu+CO2↑, CO+CuO Cu+CO2,
![]() CaCO3 CaO+CO2↑, CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3 CaO+CO2↑, CaCO3+2HCl=CaCl2+H2O+CO2↑
35.(每空1分,共6分) A:C B:CO C:H2 D:Fe E:Cu F:CuO
36.(每空1分,共6分)
| 实验内容 | 实验现象 | 化学方程式 | 属于何种“胖听” |
|
| 水珠 | 2H2+O2 2H2O | 化学性“胖听” |
| 浑浊 | CO2+Ca(OH)2=CaCO3↓+H2O | 生物性“胖听” |
37.(共6)
(1)排除空气,防止CO与空气混合后受热爆炸(1分)
(2)黑色氧化铜变红(1分);CuO被CO还原成Cu(1分)
(3)澄清石灰水变浑浊(1分);CO与CuO反应生成CO2,CO2跟石灰水反应生成CaCO3沉淀(1分)(必须说出前半句)
(4)点燃有毒的CO,防止污染空气(1分)。
五.计算题(本题共11分)
38.(共4分)
解:设生成0.2g氢气所需纯铁的质量为x,生成硫酸亚铁的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.2g
(1) 56:2=x:0.2g, x=5.6g 1分
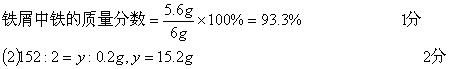
39.(共7分)
![]()
(2)设需要碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
100:44=x:2.2g, x=5g 2分
(3)设需要盐酸的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
y 2.2g
73:44=y:2.2g, y=3.65g 2分
![]()
重点分析:
1.物理变化和化学变化的根本区别是有无新物质生成。属于化学变化的一定为有新物质生成A、B、D三项均无新物质生成,C项由铜与空气中的H2O、CO2、O2发生化学变化生成铜绿(碱式碳酸铜)
2.能保持氢气的化学性质为氢分子。选C
4.冰水混合物实为水即纯净物,应为氧化物,应选B
6.从题中可以看出H2O2为分子构成,运用物质拽元素、分子拽原子的原则和分子与原子的区别来判断此题,A为正确。
9.运用质量守恒定律来推断TNT的化学式反应前后原子种类和个数不变,计算出反应后O、H、C、N的原子个数再减去42个“O”来确定TNT的化学式为A。
10.从给的角鲨烯(C30H50)的化学式,pdc 观上用物质拽元素,微观上用分子拽原子,及相对分子质量及C、H原子个数比分别确定每项是否正确,应选A。
13.题中要求最简便方法一次就能鉴别出来应用B项方法,有不同的现象即可区别开来。
![]()
![]() 14.此题为推断题关键是抓住典型现象,本题要抓住固体B(为碳),气体C为CO2,C+B→D即CO2+C 2CO。∴选B
14.此题为推断题关键是抓住典型现象,本题要抓住固体B(为碳),气体C为CO2,C+B→D即CO2+C 2CO。∴选B
15.此题要确定“Fe”与“O”的原子个数可分别设Fe的原子个数为x, “O”的原子个数为y

16.此题为信息题,根据题信息可知“纳米”的概念及其性质来推断A、B、D为正确的而C CuO不是金属所以为错的。应选C
![]() 17.本题考查置换反应,及质量守恒的概念,A为正确的,B根据质量守恒为对的;C若A和B为化合物,则C与D不一定为化合物,如CO+CuO===Cu+CO2,
∴C为错的,D中生成物为Cu的不一定是反应物为CuO,也可为Fe+CuSO4=FeSO4+Cu ∴应选A、B
17.本题考查置换反应,及质量守恒的概念,A为正确的,B根据质量守恒为对的;C若A和B为化合物,则C与D不一定为化合物,如CO+CuO===Cu+CO2,
∴C为错的,D中生成物为Cu的不一定是反应物为CuO,也可为Fe+CuSO4=FeSO4+Cu ∴应选A、B
18.根据质量守恒定律可知A、C、D三项为对的,B为错误的,应选B
 20. 此题用化学方程式来计算,如氧气正好需氢气多少克,如氢气正好需氧气多少,最后将两种可能性的质量进行比即可。
20. 此题用化学方程式来计算,如氧气正好需氢气多少克,如氢气正好需氧气多少,最后将两种可能性的质量进行比即可。

21.根据质量守恒定律,用化学式分别求出碳元素和氢元素的质量,然后碳元素+氢元素的质量与3g比较,如正好相等,即该物质只有“C、H”两元素,如小于3g,即该物质除“C、H”两元素外还有氧元素。
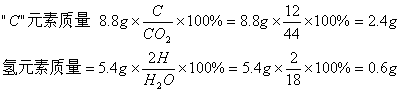
2.4g+0.6g=3g 正好等于3g ∴由“C、H”元素组成,一定不含氧元素,选A、B
22.A方法正确的 B为错误的应通入石灰水,C为对的Fe+CuSO4=Cu+FeSO4 D为正确的,先除尽CO2,只有CO再与灼热CuO反应生成CO2,最后通入石灰水,即证明CO2中含少量CO。
23.此题为难题
14g生成O2质量为14g-9.2g=4.8g
 2KClO3 2KCl+3O2↑
2KClO3 2KCl+3O2↑
245 96
x 4.8g
x=12.25g
∴14g中有MnO2质量为1.4g-12.25g=1.75g

24.根据题意Zn与Fe全部溶解,则说明酸多金属少,以Zn与Fe来计算H2,因为Zn出H2少,Fe出H2比Zn多,所以天平指针偏向Zn的烧杯一边。
25.从溶解度曲线图中可看出B项是对的,A、C为错的,D没说明是饱和溶液,所以t2降到t10C时,B析出的晶体可能比A多。是正确的。
选B、D
30.设原溶液质量为x
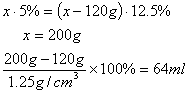
![]() 32.根据题意可知增加4g为氧元素质量
32.根据题意可知增加4g为氧元素质量
CO+CuO Cu+CO2 Δ “O”
28 16
x 4g
x=7g
CO2质量=10g-7g=3g
CO:CO2质量比=7:3
33.A、B、C反应前与反应后相比.质量增加的为生成物、质量减少的为反应物。
A 5g增加1g反应后剩余物无C所以可确定化学方程式:
![]()
∴参加反应的B物质为5g+1g-4g=2g
B:C=2g:4g=1:2
34.运用排列组合两两相遇看有几个能生成CO2的方程式再写出方程式。
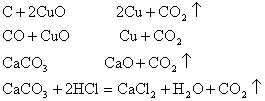
35.从B为有毒气体-CO,D为金属且在地壳中存在仅次于铝的含量可知为Fe,来进行推断。
36.此题虽为信息题但从实验现象可推出产生的气体分别为H2O和CO2。
39.(3)求盐酸中HCl的质量还是用2.2gCO2来求与石灰石无关。即使按CaCO3来求,也不能用含杂质20%的石灰石来求HCl的质量,方程式的计算应将纯量代入方程式来计算
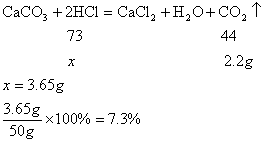
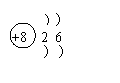 原子结构示意图
原子结构示意图