中考模拟考试题
一、选择题:
下列每小题只有一个选项符合题意。
1、下列物质中,能导电的是a
A.蔗糖 B.酒精 C.KNO3晶体 D.食盐水
2、下列物质中,属于酸的是
A.KNO3 B.NaOH C.H2SO4 D.NaCl
3、下列物质中,属于正盐的是
A.NaHCO3 B.Na2SO4 C.Ba(OH)2 D.H2S
4、下列物质中,属于酸性氧化物的是
A.MgO B.Fe2O3 C.CO2 D.H2O
5、下列电离方程式中,正确的是
A.![]()
B.![]()
C.![]()
D.![]()
6、下列物质中,易溶于水的是
A.Fe2O3 B.BaSO4 C.CaCO3 D.NaCl
7、下列物质中,金属活动性最强的是
A.Ca B.Cu C.Fe D.Zn
8、下列金属中,不能与稀硫酸反应生成氢气的是
A.锌 B.铜 C.铁 D.钡
9、下列溶液中,pH值大于7的是
A.盐酸 B.氢氧化钠溶液
C.生石灰溶于水 D.硝酸溶液
10、下列反应中,必于复分解反应的是
A.2KClO3![]() 2KCl
+ 3O2
2KCl
+ 3O2
B.Fe + 2HCl![]() FeCl2
+ H2
FeCl2
+ H2
C.2Mg + O2![]() 2MgO
2MgO
D.Na2CO3 + 2HCl![]() 2NaCl
+ H2O + CO2
2NaCl
+ H2O + CO2
11、下列叙述中,与铁的化学性质有关的是
A.铁能传热、导电
B.纯铁是银白色的有金属光泽的金属
C.铁在潮湿的空气中能生锈
D.纯铁有良好的延展性
12、下列溶液中,能使紫色石蕊试液变蓝的是
A.澄清的石灰水 B.盐酸溶液
C.食盐水 D.二氧化碳溶于水
13、下列溶液中,能使无色酚酞试液变红的是
A.稀硫酸溶液 B.氯化钠溶液
C.苛性钠溶液 D.水
14、下列溶液中,能使紫色石蕊试液变红的是
A.澄清的石灰水 B.食盐水
C.氢氧化钠溶液 D.氯化氢气体溶于水
15、下列物质的性质中,属于化学性质的是
A.浓硫酸有吸水性 B.硫酸有酸性
C.浓盐酸有挥发性 D.食盐溶于水
16、下列物质的溶液中,滴加火碱溶液,能产生蓝色沉淀的是
A.CuSO4 B.Ba(OH)2 C.CaCl2 D.KNO3
17、下列物质的溶液中,滴加氢氧化钠溶液,能产生红褐色沉淀的是
A.MgCl2 B.Na2SO4 C.FeCl3 D.CuCl2
18、除去盛放石灰水的试剂瓶内壁上的白膜,应该加入的试剂是
A.氢氧化钠溶液 B.稀盐酸
C.食盐水 D.CaCl2溶液
19、下列物质溶于水,不能发生化学反应的是
A.NaOH和HCl B.BaCl和Na2SO4
C.NaNO3和CuCl2 D.NaCl和AgNO3
20、下列物质溶于水,能发生化学反应的是
A.NaCl和KNO3 B.NaOH和BaCl2
C.CaCl2和FeCl3 D.Ba(OH)2和Na2SO4
21、鉴别硫酸和盐酸,应该选用的试剂是
A.氯化钡溶液 B.硝酸银溶液
C.无色酚酞试液 D.紫色石蕊试液
22、下列物质中,不用密封保存的是
A.浓硫酸 B.氯化钠固体 C.浓盐酸 D.烧碱固体
23、能将水、氯氧化钡溶液、稀盐酸区分开的一种试剂是
A.无色酚酞试液 B.氯化钡溶液
C.紫色石蕊试液 D.硝酸银溶液
24、下列气体中,不能用固体氢氧化钠干燥的是
A.CO2 B.H2 C.O2 D.CO
25、为证明铜的金属活动性比银强,需要的一种试剂是
A.碳酸钠溶液 B.硝酸银溶液 C.盐酸 D.氯化钙溶液
26、钢铁制品除锈(主要成分是Fe2O3),应该选用的试剂是
A.硫酸铜溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.盐酸
27、质量相同的锌和铁,分别与足量的稀硫酸反应,生成氢气的质量比为
A.2∶3 B.65∶56 C.56∶65 D.1∶1
28、下列物质中,既能与水反应,又能与盐酸反应的是
A.CuO B.Ca(OH)2 C.CaO D.Na2CO3
29、20克溶质的质量分数为10%的氢氧化钠溶液与20克盐酸恰好完全反应,那么,盐酸中溶质的质量分数为
A.5.7% B.4.6% C.9.1% D.10%
29、等质量的锌片与下列溶液充分反应后,溶液质量减少的是
A.稀硫酸 B.硝酸银溶液
C.硫酸铜溶液 D.硫酸亚铁溶液
30、下列各组物质,均易溶于水的是
A.NH4Cl、Na2CO3、AgNO3 B.Na2SO4、CaCl2、AgCl
C.NaCl、BaSO4、NaOH D.CaCO3、CuCl2、KNO3
31、下列物质的变化,不能一步实现的是
A.CuOCuSO4 B.CuSO4ZnSO4
C.FeFe3O4 D.CuOCu(OH)2
32、下列各组物质的溶液,pH值小到大顺序排列的是
A.H2SO4、KOH、NaCl B.NaOH、NaCl、H2O
C.HNO3、KCl、Na2CO3 D.CaCl2、Ba(OH)2、H2O
33、下列各组物,能在水溶液中大量共存的是
A.Na2SO4、CuCl2、KOH B.NaCl、Na2CO3、NaOH
C.NaCl、KNO3、AgNO3 D.Ba(OH)2、H2SO4、HCl
34、能用于鉴别盐酸、氯化铁、硝酸铜、硫酸钠四种溶液的一种试剂是
A.BaCl2溶液 B.NaOH溶液
C.AgNO3溶液 D.Ba(OH)2溶液
35、将下列各组溶液依次混合,(酸过量)最后没有沉淀的是
A.AgNO3、HCl、K2SO4 B.Na2SO4、HNO3、BaCl2
C.Na2CO3、BaCl2、HNO3 D.K2CO3、AgNO3、HCl
36、有X、Y、Z三种金属,若将Z放入X的盐溶液中,Z表面复盖有X;将Y和Z分别投入稀盐酸中,Y溶解而Z不溶。问这三种金属的活动性顺序正确的是
A.Y>X>Z B.X>Z>Y
C.Y>Z>X D.X>Y>Z
37、胃酸(主要万分是盐酸)过多的病人服用含氢氧化铝(Al(OH)3)的药物治疗时,所发生的化学反应属于
A.复分解反应 B.置换反应
C.化合反应 D.分解反应
38、将下列各组物质(三种)的溶液充分混合,在滤纸上能肯定留下两种不溶物质的是
A.FeCl3、Ba(OH)2、Na2SO4 B.K2SO4、NaOH、CuCl2
C.NaOH、H2SO4、K2CO3 D.MgSO4、HCl、Ba(OH)2
39、铁粉入硝酸银和硝酸铜的混合溶液中,充分反应后过滤,滤纸上的残留物可能是
A.铁和银 B.只有银 C.只有铜 D.铁和铜
40、溶液的质量相同,溶质的质量分数也相同的稀硫酸分别与下列物质反应所得到的溶液中溶质的质量分数最大的是
A.ZnO B.ZnCO2 C.Zn D.Zn(OH)2
41、向10克溶质的质量分数为2%的苛性钠溶液中逐滴加入10克溶质的质量分数为2%的盐酸,反应过程中溶液的pH随加入盐酸质量(mHCl)的变化符合下列图示的是

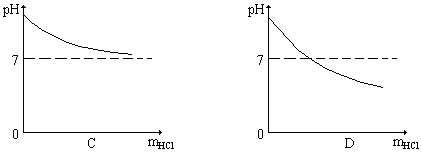
42、下列各组物质,只借助于水就可以鉴别的是
A.CuSO4、KOH、NaOH B.BaSO4、CuSO4、NaCl
C.CaCO3、BaCO3、Na2CO3 D.AgNO3、KNO3、NaCl
43、下列化合物中,氮元素的化合价属于-3价的是
A.NH4Cl B.N2 C.N2O3 D.HNO3
44、下列物质在纯氧气中燃烧,能产生明亮的蓝紫色火焰的是
A.氢气 B.一氧化碳 C.硫横 D.木炭
45、在托盘天平两端各放一只盛有过量稀硫酸的烧杯,调解天平使之平衡;往右边烧杯中放入一定量的镁条,往右边的烧杯中放入与镁条质量相同的铜、铝合金;待能反应的金属完全反应后,发现天平仍保持平衡。那么,合金中铜与铝的质量比为
A.1∶2 B.2∶1 C.1∶1 D.3∶1
二、填表:
1、填表:
| 俗称 | 名称 | 化学式 | 类别 |
| 火碱 |
|
|
|
|
| 氢氯酸 |
|
|
|
|
| Ca(OH)2 |
|
| 胆矾 |
|
|
|
|
| 氧化钙 |
|
|
2、氢氧化钠是 色的 体, 于水。它露置在空气中,表面会发生潮解,这是因为它 的缘故。同时它还能与空气中的 发生反应,其化学方程式为 ,从而使氢氧化钠变质;因此,氢氧化钠固体必须 保存;而它的水溶液也必须 保存。
3、以H、O、K、S四种元素中,选择适当的元素组成下列各类物质。(要求写化学式且每类物可能不只一种)
(1)碱 。
(2)含氧酸 。
(3)碱性氧化物 。
(4)酸性氧化物 。
(5)酸式盐 。
(6)正盐 。
4、浓硫酸稀释时,一定要把 沿器壁 倒入 里,并且用 不断搅拌;使产生的 迅速扩散。
5、用赤铁矿石(主要成分是Fe2O3)冶炼铁的主要反应的化学方程式为 。在反应中,还原剂是 ,被还原的物质是 。
6、现有铁、石灰水、硝酸钡溶液,碳酸钠溶液、稀盐酸,这五种物质分别是下图A、B、C、D、E中的一种物质:
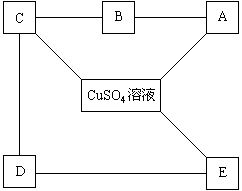
它们之间的连线表明相邻的两种物质之间能发生化学反应。由此推断图中A、B、C、D、E表示的物质可能是(请写化学式):
A ,B ,C ,
D ,E 。
发生有关反应的化学方程式为:
(1) ,
(2) ,
(3) ,
(4) ,
(5) ,
(6) ,
(7) 。
三、简答题:
1、现有HCl、NaOH、FeCl3、CuSO4、AgCl五种物质的溶液,从其中选用适当的物质实现下列要求的反应,写出有关反应的化学方程式即可:
(1)有红褐色沉淀生成的反应:
;
(2)有水生成的反应:
;
(3)有蓝色沉淀生成的反应:
;
(4)有白色沉淀生成且不溶于稀硝酸的反应:
① ;
② 。
2、用最简便的方法检验生石灰水中含有未完全分解完的碳酸钙:
(1)所加试剂是 ;
(2)观察到的现象是 ;
(3)有关反应的化学方程式 。
3、下列各题中括号内的物质为少量杂质,请写出用一种试剂除去杂质的化学方程式:
(1)NaOH(Na2CO3):
;
(2)NaCl(Na2CO3):
;
(3)NaCl(Na2SO4):
;
(4)NaCl(MgCl2):
。
4、写出实现下列转化的化学方程式(各举一例即可):
(1)有气体生成的化学方程式:
;
(2)有水生成的化学方程式:
;
(3)有沉淀生成的化学方程式:
。
四、实验题:
1、有一包固体粉末,可能由Na2CO3、BaCl2、CuSO4、Na2SO4、KNO3中的一种或几种组成。做如下实验:
(1)将此固体粉末加水、搅拌、过滤,得无色溶液及白色沉沉;
(2)将白色沉淀加适量稀HCl,沉淀部分溶解,同时产生无色气体,该气体能使澄清石灰水变浑浊;
(3)将未溶解的白色沉淀加入稀硝酸,白色沉淀不溶解。
推断:原固体粉末中一定含有 ,可能含有 ,一定不含有 。
写出有关反应的化学方程式:
① ;
② ;
③ ;
④ 。
2、由一种碱和一种正盐组成的固体混合物,按下列步骤进行实验。
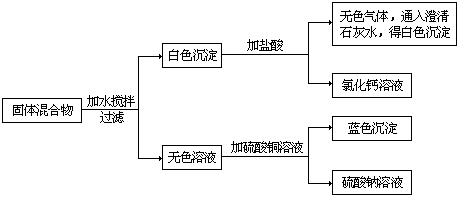
由上述实验步骤、实验现象及生成物推断,该混合物可能由 组成。
五、计算题:
1、将二氧化碳通入氢氧化钠溶液中,完全反应后,溶液增重17.6克。求参加反应的氢氧化钠的质量是多少克?
2、用20吨含Na2CO3 60%的天然碱与消石灰反应来制取火碱,在生产过程中损失Na2CO3 1%,试计算能生产98%的火碱多少吨?
3、把铜和氧化铜的混合物2克,通入足量的氢气,加热充分反应,得到1.84克铜。那么,原混合物中氧化铜的质量分数是多少?
4、10克氯化钾溶液与10克硝酸银溶液恰好完全反应,生成沉淀1.435克,求:
(1)硝酸银溶液中,溶质的质量分数是多少?
(2)反应后溶液中溶质的质量分数是多少?
(3)若20℃时,硝酸钾的溶解度为31.6克,要使反应后的溶液变成20℃时的饱和溶液,需要蒸发掉水多少克?
【参考答案】:
一、选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | C | B | C | C | D | A | B | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | C | A | C | D | B | A | C | B |
| 题号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 |
| 答案 | C | D | A | B | C | A | B | D | C |
| 题号 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 |
| 答案 | C | B | A | D | C | B | D | C | C |
| 题号 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 |
| 答案 | A | A | B | C | D | B | A | C | D |
二、填空题:
1、填表:
| 俗称 | 名称 | 化学式 | 类别 |
|
| 氢氧化钠 | NaOH | 碱 |
| 盐酸 |
| HCl | 碱 |
| 熟石灰 | 氢氧化钙 |
| 碱 |
|
| 五水硫酸铜 | CuSO4·5H2O | 盐(或结晶水合物) |
| 生石灰 |
| CaO | 碱性氧化物 |
2、 白;固;易溶;吸收空气中的水蒸气
二氧化碳
2NaOH + CO2![]() Na2CO3
+ H2O
Na2CO3
+ H2O
密封;密封
3、 (1)NaOH
(2)H2SO3 H2SO4
(3)Na2O
(4)SO2 SO3
(5)NaHSO3 NaHSO4 NaHS
(6)Na2SO3 Na2SO4 Na2S
4、浓硫酸;慢慢;水;玻璃棒;热量
5、![]()
CO;Fe2O3
6、A:Fe B:HCl C:Ca(OH)2 D:Na2CO3 E:Ba(NO3)2
![]()
![]()
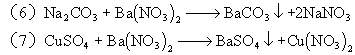
三、简答题:
1、 (1)3NaOH + FeCl3![]() Fe(OH)3¯
+ 3NaCl
Fe(OH)3¯
+ 3NaCl
(2)NaOH
+ HCl![]() NaCl
+ H2O
NaCl
+ H2O
(3)2NaOH
+ CuSO4![]() Cu(OH)2¯
+ Na2SO4
Cu(OH)2¯
+ Na2SO4
(4)①HCl
+ AgNO3![]() AgCl¯
+ HNO3
AgCl¯
+ HNO3
②FeCl3 + 3AgNO3![]() 3AgCl¯
+ Fe(NO3)3
3AgCl¯
+ Fe(NO3)3
2、 (1)稀盐酸
(2)有无色气体生成
(3)2HCl
+ CaCO3![]() CaCl2
+ H2O + CO2
CaCl2
+ H2O + CO2
3、 (1)Na2CO3
+ Ca(OH)2![]() CaCO3¯
+ 2NaOH
CaCO3¯
+ 2NaOH
(2)Na2CO3
+ 2HCl![]() 2NaCl
+ H2O + CO2
2NaCl
+ H2O + CO2
(3)Na2SO4
+ BaCl2![]() BaSO4¯
+2NaCl
BaSO4¯
+2NaCl
(4)MgCl2
+ 2NaOH![]() Mg(OH)2¯
+ 2NaCl
Mg(OH)2¯
+ 2NaCl
4、 (1)2KClO3![]() 2KCl
+ 3O2
2KCl
+ 3O2
(2)NaOH
+ HCl![]() NaCl
+ H2O
NaCl
+ H2O
(3)CuSO4
+ BaCl2![]() BaSO4¯
+CuCl2
BaSO4¯
+CuCl2
四、实验题:
1、 一定含有:Na2SO4、Na2CO3、BaCl2
可能含有:KNO3
一定不含有:CuSO4
①Na2SO4 +
BaCl2![]() BaSO4¯
+ 2NaCl
BaSO4¯
+ 2NaCl
②Na2CO3 +
BaCl2![]() BaCO3¯
+ 2NaCl
BaCO3¯
+ 2NaCl
③BaCO3 + 2HCl![]() BaCl2
+ H2O + CO2
BaCl2
+ H2O + CO2
④Ca(OH)2 + CO2![]() CaCO3¯
+ H2O
CaCO3¯
+ H2O
2、NaOH和CaCO3或Ca(OH)2和Na2CO3(组成)
五、计算题:
1、 分析:根据质量守恒定律,增加的质量必为参加反应的二氧化碳的质量。
解:设参加反应的氢氧化钠的质量为x
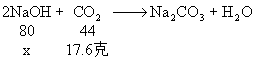
![]()
![]()
答:略
2、 分析:
(1)20吨天然碱中含纯Na2CO3的质量可求:
20吨×60% = 12吨
(2)由于实际生产中损失了1%的Na2CO3,实际用于生产即参加反应的Na2CO3的质量为:
12吨-12吨×1% = 11.88吨
因此可求生产出来的纯NaOH的质量。
解:设可生产纯NaOH的质量为x
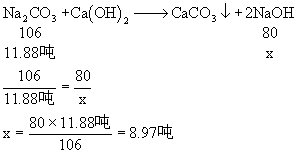
∴可得98%的火碱:
8.97吨÷98%=9.15吨
答:略
3、分析:只要明确1.84 克铜是原混合物中的铜与被还原出来的铜的总合,这道题就迎刃而解了。
解:设原混合物中铜的质量为x

解得:x = 1.2克
∴原混合物中含CuO:
2克-1.2克 = 0.8克
混合物中氧化铜的质量分数为
![]()
答:略
4、解:设参加反应的纯AgNO3的质量为x,生成硝酸钾的质量为y。

(1)10克硝酸银溶液中,溶质的质量分数:
![]()
(2)反应后,溶液的总质量:
(10+10-1.435)克 = 18.565克
反应后,溶液中溶质的质量分数:
![]()
(3)根据溶解度的概念:
设z克水溶解1.01克KNO3达到饱和:
100∶31.6 = z∶1.01
![]() (克)
(克)
应蒸发水的质量为:
(18.565-1.01-3.2)克
=14.36克
答:略
