中考化学初识酸碱盐题汇编
一、选择
1.(烟台)化学就在我们身边,生活中处处有化学。根据你所学过的化学知识,下列说法错误的是
(A)“请往菜里加点盐”中的“盐”特指食盐——NaCl
(B)体温表中的水银不是银,是金属汞
(C)食品工业中,发酵粉的主要成份是小苏打——Na2CO3
(D)生活中常用的铁制品都是铁的合金
2.(眉山市)风靡美国多年的苹果醋(ACV)浓缩饮料,其主要物质之一是苹果酸(C4H6O5)。下列说法中正确的是( D )
A、苹果酸饮料的PH>7 B、苹果酸中碳、氢、氧三种元素质量比为4:6:5
C、苹果酸可用铝制容器盛放 D、苹果酸属于有机物
3.(青岛市)实验课上,小明同学把一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液。下列判断中正确的是(AD)
A.滤出的固体中一定含有银,可能含有铜
B.滤出的固体中一定含有银和铜,一定不含锌
C.滤液中一定含有硝酸铜,一定没有硝酸锌和硝酸银
D.滤液中一定含有硝酸锌和硝酸铜,可能含有硝酸银
4.(枣庄市)现有5种物质:①浓盐酸 ②烧碱 ③食盐 ④浓硫酸 ⑤铁 把它们长期露置在空气中,其中发生化学变化且质量增加的是(B)
A.①② B.②⑤ C.③④D.③⑤
5.(枣庄市)图表资料可以为我们提供很多信息,下列从图表中获取的信息及应用不正确的是(B)
A.根据金属活动性顺序表,判断金属是否容易被盐酸腐蚀
B.根据金属的熔点数据表,判断金属的导电性强弱
C.根据溶解度曲线图,选择从溶液中获得晶体的方法
D.根据元素周期表,查找元素的原子序数、元素符号、相对原子质量等信息
6.(山东省)化学的研究目的就是帮助人们认识、改造和应用物质,把金属矿物冶炼成金属就是人们利用化学方法实现物质改造的典型范例。下表中不同的金属被开发和利用的年代不同,从化学反应的角度看,决定这一年代先后顺序的关键因素是(A)
 |
A.金属的活动性 B.金属的导电性
C.金属的延展性 D.地壳中金属元素的含量
二、填空
1.(常州)(7分)(1)影响物质性质的因素有:A.离子的种类不同;B.分子的构成不同;C.溶质的质量分数不同等,请从中选择导致下列物质性质差异的因素(填序号)。
①一氧化碳具有可燃性而二氧化碳不具有可燃性: ;
②FeSO4为绿色而Fe2(SO4)3为黄色: ;
③浓硫酸有吸水性而稀硫酸没有: 。
(2)写出具有下列用途的物质(或其主要成分)的化学式。请从以下物质中选择:
甲烷、食盐、熟石灰、氧气、碳酸氢铵、石灰石
①可作为燃料 ;
②可作为化肥 ;
③可作为调味品 ;
④可作为火箭助燃剂 。
答案: (1)①B ②A ③C(各1分)
(2)①Al ②NH4HCO3 ③NaCl ④CaCO3(各1分)
2.. (上海)鉴别物质时通常先用物理方法,后用化学方法。现需鉴别三包失去标签的白色固体粉末,它们可能是CaCO3、Na2CO3和Na2SO4,请按下表完成实验设计:
| 实验步骤 | 实验现象和结论 | |
| 步骤一: (物理方法) | ||
| 步骤二: (化学方法) |
答案:(本题共2分,合理即得分)
| 分别取样,加入足量水,振荡 | 不溶解的是CaCO3 |
| 分别向所得溶液中滴加盐酸 | 有气泡生成的是Na2CO3 无明显现象的是Na2SO4 |
3.(烟台)自然界有一种“雷雨发庄稼”的现象,即在雷雨过后,植物生长得更好。下面一段短文就是叙述雷雨中发生的一系列化学变化过程:①空气中的N2在放电条件下与O2直接化合生成元色且不溶于水的一氧化氮气体;②一氧化氮的密度比空气略大,不稳定,常温下就易与空气中的O2反应生成红棕色的二氧化氮气体;③二氧化氮气体有毒,易与水反应生成硝酸(HN03)和一氧化氮;④生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐。
请填写下列空白:
(1)上述短文中,描述二氧化氮化学性质的是 (填序号)。
(2)实验室制取一氧化氮时,下列收集方法不适宜的是 。
A.向上排空气法 B.向下排空气法 C.排水收集法
(3)写出二氧化氮与水反应的化学反应方程式: ,其中氮元素的化合价在此反应中发生的变化是 。
A.不变 B.仅升高 C.仅降低 D.既有升高又有降低
(4)“雷雨发庄稼”,植物生长得更好的原因是
答案: (5分)(1)③ A、B (3)3NO2+H20 = 2HNO3+NO D
(4)生成的硝酸盐可作氮肥
三、实验
1.(成都)现有失去标签的两瓶无色溶液:氯化钠溶液和稀盐酸。某化学探究小组打算用物理和化学两种方法加以区别。请回答:
(1)化学方法 在不选用酸碱指示剂、pH试纸的情况下,按表中方法一(示例)填写。所选试剂须属于不同物质类别(单质、氧化物、酸、碱、盐、有机物等)。
| 所选试剂 | 判别方法 | |
| 方法一 | 锌 | 取少量样品分别与锌反应,有气体产生的是稀盐酸,没有的是氯化钠溶液。 |
| 方法二 |
|
|
| 方法三 |
(2)物理方法 同学小王使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分开了。请你猜测一下他的做法:
操作方法:
判断方法:
答案:(7分)(1)开放性试题,只要符合题意即可。(3分)下面是一种可行的办法:
| 所选试剂 | 判别方法 |
| 碳酸钙 | 取少量样品分别与碳酸钙反应,有气体产生的是稀盐酸,没有的是氯化钠溶液。 |
(2)操作方法:用玻璃棒分别蘸取两种溶液,在酒精灯上灼烧。(2分)
判断方法:有固体出现的是氯化钠溶液,没有的是稀盐酸(2分)
2.(成都)某化学兴趣小组想探究某一温度下氯化钠饱和溶液的酸碱度。探究过程如下:
【猜想或假设】溶液的pH可能为:①pH<7,② ,③ 。
【设计和实验】要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的 (填序号)来进行实验。
①pH试纸 ②紫色石蕊试液 ③酚酞试液
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡比较,测得pH=7。
【评价与反思】三位同学中操作正确的是 同学。
指出其于同学的操作错误:
同学: ;
同学: ;
【结论与分析】丙同学得出:“凡是盐溶液的pH都等于7”,你认为该同学结论
(填“正确”或“不正确”)。
如不正确,请举一例说明 (如正确,该处不填)。
答案:(11分)
【猜想或假设】pH=7;pH>7(2分)
【设计和实验】②③(2分)
【评价与反思】甲;(1分)
乙同学:pH试纸不能润湿;(2分)
丙同学:pH试纸不能直接放入待测溶液中;(2分)
【结论与分析】不正确;碳酸钠(2分)
四、计算
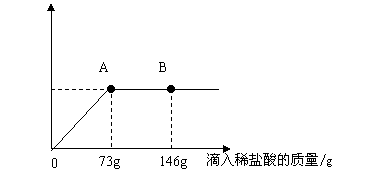
1. (济南)在一烧杯中盛有22.3g Na2CO3和Na Cl组成的固体混合物,加足量水溶解,制成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:
请根据题意回答问题:
(1)当滴加了73g稀盐酸时,放出气体的总质量为 g。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式) 。
(3)当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
![]()
答案:(共6分) (1)4.4 (1分)
(2)NaCl 、HCl (2分,答对一个给1分,有错项不给分)
(3)(共3分)解:73g10%的稀盐酸中含HCl的质量是:
73g×10%=7.3g (0.5分)
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O (1分)
106 73 117
X 7.3g y
![]()
![]()
= x=10.6g (0.5分)
![]()
![]()
= y=11.7g (0.5分)
烧杯里不饱和溶液中溶质的质量为: 117.g + (22.3g-10.6g) = 23.4g (0.5分)答:略
2.(07济宁)课外活动小组为测定某变质氢氧化钠固体中氢氧化钠的质量分数,设计、进行了下面的实验:
步骤一:取5g样品放入50mL小烧杯中,加足量的蒸馏水至样品完全溶解;
步骤二:向烧杯中滴加氯化钡试剂至不再产生沉淀为止,过滤混合物;
步骤三:将滤得的沉淀干燥,称得质量为1.97g
请根据实验回答下面问题:
⑴有同学认为也可以向样品中加入稀盐酸的方法测定氢氧化钠的质量分数,请你谈谈对这个方案的看法。
⑵根据课外兴趣小组测定的数据计算固体中氢氧化钠的质量分数?(精确到0.1%)
答案:⑴加入的盐酸没有全部用于跟碳酸钠反应,测定时所用盐酸的量偏多。另外,反应中生成的二氧化碳还需其他反应来吸收,造成计算、操作过程繁琐 (1分)
⑵解:设原混合物中碳酸钠的质量为x
Na2CO3+BaCl2=2NaCl+BaCO3↑ (1分)
106 197
x 1.97g
![]() =
=![]() x=1.06g
(1分)
x=1.06g
(1分)
已变质固体中氢氧化钠的质量分数=![]() ×100%=78.8% (1分)
×100%=78.8% (1分)
答:固体中氢氧化钠的质量分数为78.8%
