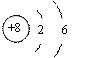初中化学综合练习(二)
本试卷分为选择题和非选择题两部分;第一部分1至3页,第二部分4至6页,共6页,满分100分。考试时间80分钟。
注意事项:
1.答卷前,考生务必在答题卡第1面和第3面上用黑色字迹的钢笔或签字笔填写自己的考生号、姓名;同时填写考场试室号、座位号,再用2B铅笔把对应这两个号码的标号涂黑。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号;不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案,改动的答案也不能超出指定的区域;不准使用铅笔、圆珠笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束时,将本试卷和答题卡一并交回。
5.全卷共三大题29小题,请考生检查题数。
第一部分 选择题 (共40分)
可能用到的相对原子质量: H 1、C 12、O 16、Na 23、S 32、Cl 35.5、Fe 56
一、选择题(注意:每道选择题有四个选项,其中只有一项符合题意。)
1、下列变化,属于化学变化的是
A、水由固态变为液态 B、氧气在一定条件下由无色变为淡蓝色
C、蒸发饱和碳酸钠溶液有沉淀产生 D、氢气在氧气中燃烧放热、发光
2、下列物质中,属于纯净物的是
A、臭氧 B、液化石油气 C、乙醇汽油 D、惰性气体
|
3、某原子的结构示意图为 , 下列说法正确的是
A.该原子的核外电子数为6 B.该原子在化学反应中易失去电子
C.该原子属于非金属元素的原子 D.该原子属于金属元素的原子
4、淀粉(C6H10O5)n是一种重要的营养物质。下列关于淀粉的说法,错误的是
A.淀粉是有机高分子化合物
B.淀粉是由碳、氢、氧三种元素组成
C.淀粉组成中碳、氢、氧原子个数比为6:10∶5
D.淀粉的相对分子质量为162
5、下列各组含氮物质中,氮元素化合价相同的一组是
A、N2 HNO3 B、NaNO3 HNO2
C、N2O5 KNO3 D、NaNO2 NO2
6、某工厂化验室配制500g23%的盐酸,需要30%的盐酸(密度为1.15 g/cm3)的体积是
A、30mL B、100mL C、115mL D、333mL
7、一瓶pH为2食醋,分别取10mL加入等体积的下列物质,食醋的pH值会减小的是
| 用品 | 盐酸 | 酱油 | 草木灰水 |
| 近似pH值 | 0 | 4~5 | 10~11 |
A、水 B、盐酸 C、酱油 D、草木灰水
8、下述说法中正确的是
A、水电解生成氢气和氧气,说明水中含有氢原子和氧原子
B、氢原子可以结合成分子,氢原子和碳原子不能结合成分子
C、干冰升华和碳的燃烧都产生二氧化碳气体,它们都是化学变化
D、金刚石和石墨都是由同种元素组成的单质,但是它们的性质不同
9、下列四个反应属于化合反应的是
A、氢气在氯气中燃烧 B、硝酸银溶液与氯化钠溶液混合
C、用一氧化碳与氧化铁的反应炼铁 D、用过氧化氢溶液和少量二氧化锰固体反应
10、下列关于实验现象的描述,正确的是
A、把一小粒碘放入水中,碘溶于水,溶液为红色。
B、浓硫酸是无色、有酸味的、黏稠状的液体
C、点燃羊毛纤维,羊毛纤维燃烧,有难闻的气味
D、木炭能够还原某些氧化物
11、实验室用用氯酸钾和二氧化锰制取氧气的实验中,需要使用的一组仪器是
A、烧杯、玻璃棒 B、大试管、集气瓶
C、分液漏斗、锥形瓶 D、漏斗、蒸发皿
12、在101 kPa时,液态氮的沸点是-195.8 ℃,液态氧的沸点是-183 ℃,液态氦的沸点是-219 ℃,液态二氧化碳的沸点是-78.44 ℃。在分离液态空气的时候,上述气体随温度升高而被分离出来的顺序为
A.氮气、氧气、氦气、二氧化碳 B.氦气、氮气、氧气、二氧化碳
C.二氧化碳、氧气、氦气、氮气 D.氮气、二氧化碳、氧气、氦气
13.下列关于氢氧化钠的叙述中不正确的是
A.固体氢氧化钠要密闭保存
B.氢氧化钠溶液久置在空气中,氢氧化钠的质量减少
C.固体氢氧化钠可用作二氧化硫气体的干燥剂
D.氢氧化钠在生活中可用来去除油污
14.某学生测定的下列数据中,不合理的是
A.用10 mL量筒量取了7.5 mL水
B.用pH试纸测得某地水的pH为7.1
C.用托盘天平称得某小苏打样品的质量为16.7g
D.测得某粗盐中氯化钠的质量分数为90.5%
15、下列实验操作错误的是
|
|
| A B C D |
16、一种无色气体X,在空气中燃烧生成另一种无色气体Y,Y与赤热的木炭反应又生成气体X,则X是
A、H2 B、O2 C、CO D、CO2
17、制造炒菜锅的手柄的材料
A、用热塑性塑料 B、热固性塑料 C、合成橡胶 D、金属铝
18、下列处理事故的方法中正确的是
A.厨房煤气管道漏气,立即关闭阀门并开窗通风
B.如果不慎将浓硫酸沾到皮肤上,立即涂上3%-5%碳酸氢钠溶液
C.贮存易燃物和易爆物品的仓库可建在闹市区,但必须贴“严禁烟火”字样或图标
D.电线老化短路而发生火灾,立即用泡沫灭火器扑灭
19、向分别盛有少量氯化钾、氯化钡、碳酸钾溶液的三支试管中,滴入2~3滴某种试液,便能区别这三种溶液。该试液是
A、硝酸银溶液 B、氢氧化钙溶液 C、盐酸溶液 D、硫酸溶液
20、对下列物质进行分类 ,其中一种与另外三种不属同一类别的是
A、烧碱 B、纯碱 C、氨水 D、消石灰
第二部分 非选择题 (共60分)
二、本题包括5小题,共34分。
21、(7分)用化学用语表示下列物质或反应:
(1)氢氧化钾 ;
(2)m个三价铁离子__________;4个甲烷分子 ;
(3) 铝片在空气中,生成致密的氧化铝薄膜,反应的化学方程式是 ;
(4)在些胃药中含有碳酸氢钠,写出它与胃酸反应的化学方程式是 。
22、(6分)T1℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃时,固体的溶解度情况如图1所示。图2为a、b、c三种物质的溶解度曲线。请仔细阅读图1和图2回答下列问题:
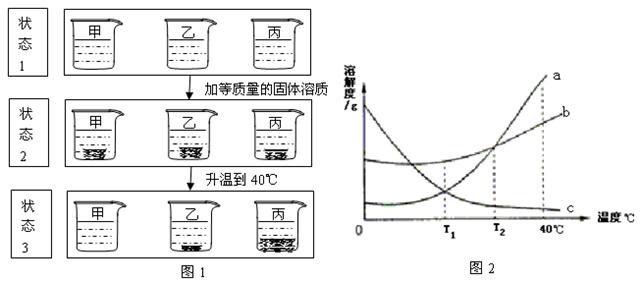
(1)三种物质的溶解度关系为b >a > c时的温度为T℃,则T的取值范围是 。
(2)烧杯甲里是_____________物质的溶液,烧杯乙里是____________物质的溶液。
(3)40℃,烧杯_____________里的溶液中溶剂最少。
(4)各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较,一定正确的是 。
A.丙(状态2)>丙(状态1)
B.甲(状态1)>丙(状态3)
C.甲(状态3)>乙(状态3)
D.丙(状态1)=甲(状态2)
23、(5分)硫酸亚铁(FeSO4)可用作饲料添加剂,畜、禽通过食用这种添加剂的饲料获得微量元素铁。
(1)某工厂利用铁屑与硫酸起反应来制取硫酸亚铁。写出反应的化学方程式 。
(2)计算
①硫酸亚铁的相对分子质量为 。
②现有硫酸溶液9.8t(硫酸的质量分数为20%),硫酸的质量为 t。
③上述硫酸与足量的铁屑起反应,可生产FeSO4的质量是 t。
24、(8分)溶液在生产和科研中具有广泛的用途,试从微观的角度分析下列问题。
(1) 蔗糖溶液中的溶质是 ,氯化钠溶液中溶质是 。
(2)铝丝与硫酸铜均为固体时,不容易反应。铝丝浸入硫酸铜溶液中,立即有红色的铜出现。请你分析原因 。
该反应的化学方程式是 。
(3)在实验室或化工生产中常常将反应物配制成溶液,原因是: 。
25、(8分)已知白色混合物粉末含有CuSO4、NaOH、Na2CO3、NaCl四种物质中的两种。实验方案如下:
I、取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液。
II、为了进一步确定该固体混合物的组成,用胶头滴管取少量上述I溶液于试管中。
 |
上述实验回答有关问题
(1)由I可以得到的结论是 。
(2)由II可以得到的结论是 。
(3)请写出试剂X的化学式 。
反应①的化学方程式为 。
反应②的化学方程式为 。
三、本题包括4小题,共26分
26、(4分)现要蒸发约20mL硝酸钾的浓溶液,得到硝酸钾晶体,需要的仪器有:
。
27、(6分)现欲配制溶质质量分数为10%的氯化钠溶液100g,实验过程如下:
(1)计算。 所需氯化钠的质量为 g; 水的质量为 g。
(2)用 称量所需的氯化钠,把称好的氯化钠倒入烧杯中。
(3)把水的密度近似地看作1g/mL。用 量取所需的水,倒入盛有氯化钠的烧杯里,用玻璃棒 ,使氯化钠全部溶解。
(4)把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签上要注明 ),放到试剂柜中。
28、(8分)自行车防雨棚采用了钢架结构,但使用不久就会生锈。某校的研究小组通过实验进行铁制品锈蚀条件的探究,了解铁制品锈蚀的条件,得到防止自行车棚的钢架锈蚀一些方法。
(1)铁制品锈蚀条件的探究
实验步骤:将三根洁净光亮的铁钉分别放入三支试管中。
在Ⅰ试管中倒入蒸馏水至浸没1/2的铁钉;
在Ⅱ试管中倒入经煮沸迅速冷却的蒸馏水,使蒸馏水浸没铁钉,并再倒入适量植物油;
在Ⅲ试管中放入棉花和干燥剂,并塞上塞子。
实验装置:
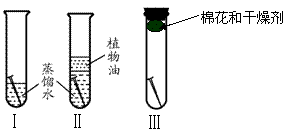 |
| 铁钉锈蚀的条件 | 一周后的实验现象 | |
| 试管Ⅰ | 铁钉表面生成一层红褐色的铁锈,位于水面和空气交界面的部分,生成的铁锈最厚。 | |
| 试管Ⅱ | 铁钉表面没有明显的锈斑 | |
| 试管Ⅲ | 铁钉仍光亮完好 |
实验结论: 。
(2)请你提出两种防止自行车棚的钢架锈蚀方法:
1. 。
2. 。
29、(8分)实验室有三瓶没有标签的无色溶液,它们分别是硫酸、硫酸钠溶液、碳酸钠溶液。现只有生锈铁钉,没有其他试剂,设计一个实验方案进行鉴别,并完成实验报告。
| 实验步骤 | 实验现象与结论 |
| 1、 | |
| 2、 |