化学模拟试题
相对原子质量:H:1;O:16;Na:23;Mg:24;Cl:35.5;Fe:56
一、选择题(共10题,每题2分)
1、日常生活中我们常观察到以下现象:①菜刀表面常产生棕黄色的斑点 ②新鲜萝卜放入泡菜坛中,几天后萝卜变酸了 ③水果腐烂后发出难闻的气味 ④把鸡蛋放入白醋中,蛋壳表面产生气泡 ⑤农田里烧麦沤肥,浓烟冲天 ⑥点燃烟花可看到美丽的焰火、闻到刺激性气味,现有四位同学就以上现象发表看法,你认为正确的是
A.甲同学认为上述现象不能判断是否发生了化学反应
B.乙同学认为上述现象表明变化后都产生了新物质,所以都发生了化学反应
C.丙同学认为除了②以外,其余都是化学变化
D.丁同学认为上述现象确实表明变化后都产生了新物质,但不一定发生了化学反应
2、自第十一届奥运会以来,历届奥运会开幕式都要举行颇为隆重的“火炬接力”。火炬的可燃物是丁烷(化学式是C4H10),它燃烧时火苗高且亮,在白天,二百米以外也能清晰可见。下列关于丁烷的叙述正确的是:
①丁烷是由碳、氢两种元素组成的;②丁烷由丁烷分子构成;③丁烷分子由碳、氢两种元素构成;④丁烷由4个碳原子和10个氢原子组成;⑤丁烷分子是由碳原子和氢原子构成。
A、①②③④⑤ B、①②⑤ C、③④ D、①②④⑤
3、 学能让我们更好的认识生活和世界。下列说法中正确的是:
A、香烟烟气中含有尼古丁等有毒物质,吸烟有害健康
B、食用经甲醛水溶液浸泡过的水产品对人体有益
C、绿色食品不含任何化学物质
D、天然物质都无毒无害
4、淀粉溶液是一种常用的化学试剂,它遇到碘水显蓝色。利用维生素C能使淀粉——碘溶液褪色的性质,可以比较苹果汁和橙汁中维生素C含量的多少。要得出正确的结论,实验过程中不需要进行控制的条件是:
A、烧杯的大小必须相等
B、烧杯中的淀粉——碘溶液的质量必须相等
C、胶头滴管滴出的每滴果汁的体积必须相等
D、胶头滴管滴出的果汁的滴数必须相等
5、向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入锌片,有气泡产生,以下判断不正确的是:
A、不溶物中一定含有铁 B、不溶物中一定含有铜
C、滤液中一定含有硫酸 D、滤液中一定含有硫酸亚铁
6、由Fe、FeO、Fe2O3和Fe3O4的两种或两种以上物质组成的混合物,已知该物质中铁、氧两种元素的原子个数比为:1︰1,则该混合物中:
A、一定同时含有Fe2O3和Fe3O4 B、一定含有FeO
C、只含有Fe和FeO、Fe2O3两种中的一种 C、不能确定是否含有FeO
7、关于右图所示装置的用途说法错误的是:
A、若用来干燥二氧化碳时,装置内应盛约半瓶浓硫酸,气体从A端进入
B、若用排空气法收集氢气时,气体从装置的A端通入
C、若用排水法收集氧气时,装置内应盛满水,气体从B端通入
D、医院给病人输氧气时,装置内盛约半瓶蒸馏水,氧气从A端通入,用来观察氧气输出的速率
8、下列说法正确的是:
A、向一定温度下的饱和溶液中加入该溶质后溶质的质量分数增大
B、饱和溶液降温析出晶体后的溶液仍为饱和溶液
C、从5010%的硫酸钠溶液中取出5g,这5g溶液中硫酸钠的质量分数为1%
D、在一定定温度下,物质X和Y具有相同的溶解度,则在该温度下X、Y的饱和溶液中含有X、Y两种物质的质量相等
9、将一定量铝粉和氧化铜混合加热,反应化学方程式为:。反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量的稀硫酸,充分反应后,将铁片插入溶液中。下列叙述的现象中,能够说明氧化铜没有完全反应的是;
①加入稀硫酸后,有气泡生成;②加入稀硫酸后,没有气泡生成;③加入稀硫酸后,溶液中有红色不溶物质;④插入溶液中的铁片表面有红色物质析出。
A、①② B、②④ C、只有④ D、②③④
10、对下列实验过程的评价,正确的是( )
A.某溶液滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中不一定含有SO42-
B.某无色溶液中滴入酚酞试液变红色,该溶液不一定是碱溶液
C.检验氢气纯度时,将一收集气体的试管移近火焰,没有响声,表明氢气纯净
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH- ,再加AgNO3溶液有白色沉淀出现,证明含Cl-
二填空题(共5题,共14分)
11、请用给定化合价的元素组成物质来填空,![]()
单质 ,氧化物 ,盐 ,含氧酸 。
12、如图所示是某个化学反应前后的微观模拟图;请根据图示回答:
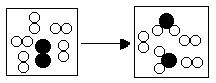
(1)该反应的基本类型为
(2)该反应中的生成物 (填“可能”或“不可能”)是氧化物。
13、某学生为证明浓盐酸具有挥发性和碳酸具有不稳定性,设计了如下实验。
(1)将石灰石和浓盐酸反应产生的气体通入紫色石蕊试液,来证明浓盐酸的挥发性。
(2)将上述已变红的石蕊试液加热煮沸,就可证明碳酸已分解。试分析实验设计的是否合理,并说明理由。
实验一:
实验二:
14、下图是从空气分离氧气的示意图:
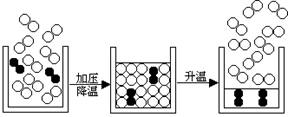 请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条。
请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条。
组成:
结构:
性质:
变化: 。
15、某同学证明盐酸与氯化氢气体的性质不同,加入20%,他向A、B、C三支试管中各放一片干燥的蓝色石蕊试纸,然后向A试管中加入盐酸,试纸显 色;往B试管中通往干燥的氯化氢气体,试纸 色。这时他认为由此还不能得出满意的结论,于是他向C试管中加入一种化学式为 的物质,试纸显 色,他之所以加这种物质的目的是:
三、实验题(共10分)
16、围绕一瓶氢氧化钠固体是否变质的问题,同学们展开探究活动。查阅资料:氢氧化钠变质生成碳酸钠;碳酸钠溶液的PH大于7。
(1)甲同学用酚酞试液检验氢氧化钠是否变质。你认为他能否成功 ,理由是:
(2)乙同学取少量固体于试管中,滴加某种试剂,有大量气泡产生,由此证明氢氧化钠已经变质。你认为所加试剂为: 。
(3)丙同学欲证明变质的固体中尚存有氢氧化钠,请帮助他完成以下探究方案:
| 探究目标 | 探究步骤 | 探究现象 |
| 目的: | 取少量固体溶于水,向其中滴加足量的 溶液。 | 产生白色沉淀 |
| 证明固体中存在氢氧化钠 | 向上述所得溶液中滴酚酞试液 | 酚酞试液变红 |
17、学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,想探究其他一些物质如Al2O3是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。
⑴问题:Al2O3能不能作过氧化氢分解的催化剂呢?⑵猜想:Al2O3能作过氧化氢分解的催化剂
⑶实验验证:
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 木条不复燃 | 常温下过氧氢溶液不分解 | |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 |
⑷结论:Al2O3能加快过氧化氢的分解速率,故可以作过氧化氢分解的催化剂
⑸讨论与反思:经过讨论有产同学诊断只有上述两个证据,不能证明Al2O3能作过氧化氢的催化剂,还需要再补充一个探究实验。
实验三:[实验目的]探究:
[实验步骤]①准确徇Al2O3的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤, ,称量;④对比反应前后Al2O3的质量。
[讨论]如果Al2O3在反应前后质量不变, 则说明Al2O3可以作过氧化氢分解的催化剂
⑹但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验。
探究:
四、计算题(共6分)
18、某课外兴趣小组对一批铁样品(含有杂质、杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
| 甲 | 乙 | 丙 | |
| 稀硫酸质量 | 200g | 150g | 150g |
| 加入的铁样品质量 | 9g | 9g | 14g |
| 生成氢气的质量 | 208.7g | 158.7g | 163.7g |
请你认真分析数据,回答下列问题:哪位同学所取用的稀硫酸与铁样品恰好完全反应?
,生成氢气的质量是 。
 19、含有盐酸与氯化镁的混合溶液50克,向其中滴加溶质质量分数为20%的氢氧化钠溶液,所加入氢氧化钠溶液的质量与生成沉淀质量的关系如图所示。求原溶液中氯化镁的质量。
19、含有盐酸与氯化镁的混合溶液50克,向其中滴加溶质质量分数为20%的氢氧化钠溶液,所加入氢氧化钠溶液的质量与生成沉淀质量的关系如图所示。求原溶液中氯化镁的质量。
