2008年乐山市高中阶段教育学校招生考试化学卷
化学试题
可能用到的相对原子质量 H—1 C—12 O—16 Na—23 S—32 Cl—35.5 K—39 Ba—137
一.选择题(35分)
17.将少量下列物质分别放入水中,充分搅拌,不能形成溶液的是
A.蔗糖 B.牛奶 C.酒精 D.白醋
18.下图所示的家庭小实验中,主要发生物理变化的是
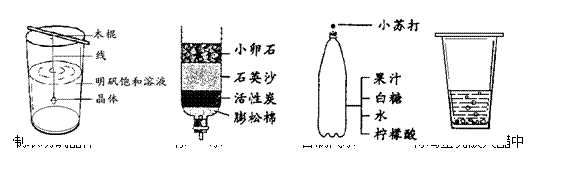 |
A B C D
19.日常生活中,化学无处不在。根据你所掌握的化学知识判断,下列作法中不正确的是
A.用木炭除冰箱异味
B.用肥皂区分硬水和软水
C.将用过的铁锅洗净擦干以防生锈
D.经常将用过的铝锅或铝壶擦拭得光亮如新
20.乐山是一座亲水城市,水是乐山的灵魂,我们应象珍惜自己的血液一样珍惜每一滴水。下列关于水的说法中不正确的是
A.水是由氢元素和氧元素组成的化合物
B.城市污水必须经过净化处理后才能排放
C.清澈、透明的泉水是纯净物
D.水资源是宝贵的,一定要节约用水
 21.下列同学对“SO2”的认识中,不正确的是
21.下列同学对“SO2”的认识中,不正确的是
![]()
22.硅材料是太阳能电池及电脑芯片不可缺少的材料,随着一批多晶硅生产企业在乐山建成投产,乐山将成为我国重要的硅材料产业基地。下面是多晶硅生产过程中的一个重要反应: SiO2+2C
![]() Si
+2CO↑,该反应的基本类型是
Si
+2CO↑,该反应的基本类型是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
23.农作物缺磷时,会引起生长迟缓、产量降低,必须施用适量的磷肥。过磷酸钙[Ca(H2PO4)2和CaSO4的混合物]是常用的磷肥。其中,磷的化合价为
A.+2 B.+3 C.+4 D.+5
24.下图所示实验操作错误的是
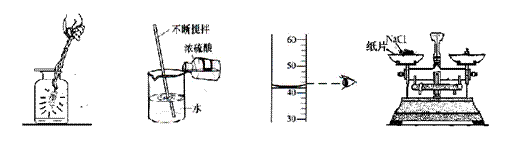
A B C D
25.类推是学习化学的一种重要方法,但盲目类推又可能得出错误结论。下列类推正确的是
A.原子和分子均是微观粒子,原子在化学变化中不能再分,则分子在化学变化中也不能再分
B.锌和铜均是金属,锌能与稀硫酸反应放出氢气,则铜也能与稀硫酸反应放出氢气
C.金刚石和石墨都是碳的单质,金刚石十分坚硬,则石墨也十分坚硬
D.硫酸与盐酸均是酸,H2SO4在水溶液中能电离出H+,则HCl在水溶液中也能电离出H+
26.对“大棚”农作物施用“汽水”(碳酸溶液),是近年来在种植生产中兴起的一种新方法。对于其作用的下列几种叙述:①加速植物光合作用;②冬天有助于农作物“防冻”;③有利于改良碱性土壤,调节pH;④可促进土壤中的Ca2+、Mg2+被植物吸收。其中正确的是
A.①②③ B.②③④ C.①③④ D.全部
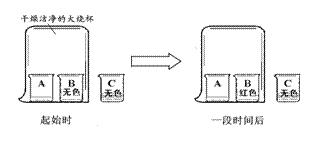 27.A、B、C三只小烧杯内分别依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按下图所示进行探究活动,不能得到的结论是
27.A、B、C三只小烧杯内分别依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按下图所示进行探究活动,不能得到的结论是
A.氨水能使酚酞溶液变红
B.碱能使酚酞溶液变红
C.空气不能使酚酞溶液变红
D.浓氨水易挥发,氨气易溶于水
![]() 28.2008年北京奥运会的火炬“祥云”将于8月3日传递到乐山。团结、互助、友爱、勇敢、坚强!大灾之后,“祥云”火炬的传递增添了新的意义。“祥云”火炬燃烧时的主要反应为:5O2+X
3CO2+4H2O。由此可知,“祥云”火炬燃料X的化学式为
28.2008年北京奥运会的火炬“祥云”将于8月3日传递到乐山。团结、互助、友爱、勇敢、坚强!大灾之后,“祥云”火炬的传递增添了新的意义。“祥云”火炬燃烧时的主要反应为:5O2+X
3CO2+4H2O。由此可知,“祥云”火炬燃料X的化学式为
A.C3H7OH B.CH4 C.C2H6 D.C3H8
![]() 29.从6月1日起,国内所有的超市、商场等商品零售场所开始实行塑料购物袋有偿使用制度,这将有助于减少因使用不可降解塑料引起的“白色污染”。常见的包装袋很多是由聚氯乙烯塑料(PVC)加工而成的,其化学式可表示为
,可看作由n个ClCHCH2(氯乙烯)连接而成,是一种不可降解塑料。下列有关聚氯乙烯的说法,不正确的是
29.从6月1日起,国内所有的超市、商场等商品零售场所开始实行塑料购物袋有偿使用制度,这将有助于减少因使用不可降解塑料引起的“白色污染”。常见的包装袋很多是由聚氯乙烯塑料(PVC)加工而成的,其化学式可表示为
,可看作由n个ClCHCH2(氯乙烯)连接而成,是一种不可降解塑料。下列有关聚氯乙烯的说法,不正确的是
A.相对分子质量为62.5n
B.各元素的质量比为71:48:6
C.它属于有机合成材料
D.在长时间光照下可以分解
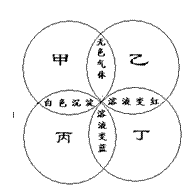 30.下面右图中,四圆甲、乙、丙、丁分别表示一种溶液,两圆的相交部分为两溶液混合后出现的主要实验现象,下表中符合图示关系的是
30.下面右图中,四圆甲、乙、丙、丁分别表示一种溶液,两圆的相交部分为两溶液混合后出现的主要实验现象,下表中符合图示关系的是
|
| 甲 | 乙 | 丙 | 丁 |
| A | Na2CO3 | H2SO4 | Ba(OH)2 | 石蕊 |
| B | Na2CO3 | HCl | Ca(OH)2 | CuSO4 |
| C | Na2SO4 | HCl | Ba(OH)2 | 石蕊 |
| D | HCl | Na2CO3 | Ca(OH)2 | 酚酞 |
![]()
二.填空题(14分)
41.(2分)下列物质是家庭生活的常用物质:①食盐、②铁锅、③碘酒、④木炭。
(1)写出食盐的化学式 ;(2)属于单质的是(填标号) 。
42.(3分)学好化学能使我们更好地认识各种现象,更轻松、合理地解决实际问题。
回答下列问题:
(1)家里炒菜时油锅着火,最好的灭火方法是 ;
(2)有的胃病患者胃酸过多,常服用一些含氢氧化铝的药物,有关反应的化学方程式为 。
(3)烧煤气(主要成分为CO)的家用燃气灶,改烧天然气后,空气进气管的直径应 。
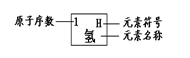 43.(4分)元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信:
43.(4分)元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信:
| 1H 氢 | 2He 氦 | |||||||
| 3Li 锂 | 4Be 铍 | 5B 硼 | 6C 碳 | 7N 氮 | 8O 氧 | 9F 氟 | 10Ne 氖 | |
| llNa 钠 | 12Mg 镁 | 13A1 铝 | 14Si 硅 | 15P 磷 | 16S 硫 | XC1 氯 | 18Ar 氩 | |
| 19K 钾 | 20Ca 钙 | …… | ||||||
认真分析信息,回答:
(1)地壳中含量最多的元素的原子序数是___________ ;
 (2)分析上表规律,可推知,表中X =
;
(2)分析上表规律,可推知,表中X =
;
(3) __(钙 表示的是(写粒子符号) 。
(4)写出一个由1、7、8、16号四种元素组成的化合物的化学式 。
44.(5分)在下面关系图中,A、B、C、D是初中化学中常见的单质,甲、乙分别是酒精燃烧时一定会产生的两种物质,丁是常用建筑材料的主要成分,G为无色有刺激性气味的气体,能使紫色石蕊变蓝,J是赤铁矿的主要成分。
 |
(1)写出化学式:甲是 ,G是 ;
(2)写出H与J反应的化学方程式: ;
(3)J溶解于稀盐酸中,溶液呈黄色,反应完全后,再向溶液中加入纯净的D的粉末,溶液逐渐变成浅绿色,写出有关变化的化学方程式:
。
三.实验与探究(11分)
45.(5分)小明同学在实验操作考核中,要完成的题目是“二氧化碳的制取、收集和验满”。
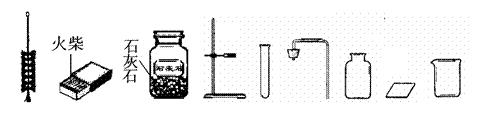
(1)上面是实验桌上摆放好的该实验所需的用品,小明同学发现其中缺少了一种实验仪器和一种药品,请你写出所缺仪器的名称 ;所缺药品是 ;
(2)写出制气反应的化学方程式: ;
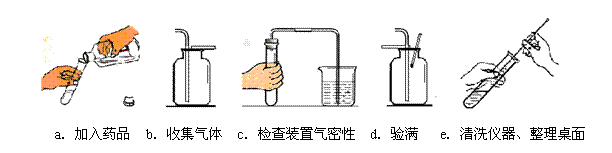
(3)下图是小明实验时的主要步骤,这些步骤的正确顺序是(填字母标号,下同) ,其中操作有误的是 。
46.(6分)小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题。他设计并完成了下表所示的探究实验:
| 实验操作 | 实验现象 | 实验结论或总结 | ||
| 各步骤结论 | 总结 | |||
| 实验一 | 将氯酸钾加热至融化,伸入带火星的木条, | 木条复燃 | 氯酸钾受热要分解产生氧气,但是 。 反应的化学方程式为: 。 | 二氧化锰是氯酸钾受热分解的催化剂 |
| 实验二 | 加热二氧化锰,伸入带火星的木条, | 木条不复燃 | 二氧化锰受热不产生氧气。 | |
| 实验三 |
| 木条迅速复 燃 | 二氧化锰能加快氯酸钾的分解 | |
(1)请你帮小明同学填写上表中未填完的空格;
(2)在小明的探究实验中,实验一和实验二起的作用是 ;
(3)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是: ;第二方面的实验是要 。
|
47.右图是“△△牌”钾肥的部分信息:
根据该信息计算:
(1)硫酸钾中各元素的质量比;
(2)该钾肥中钾元素的含量最高为多少?
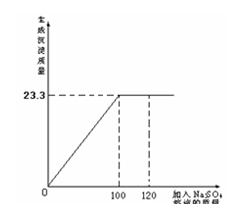 48.将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(P水 = 1g/cm3),向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应。右图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
48.将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(P水 = 1g/cm3),向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应。右图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
(1)生成沉淀的质量是多少?
(2)所得溶液中溶质的质量分数为多少?
化学参考答案及评分意见
一.(每小题2.5分,共35分)
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
| 答案 | B | B | D | C | B | A | D |
| 题号 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | C | C | D | B | D | D | A |
二.(每空1分,共14分)
41.(2分)(1)NaCl (2)④ 。
42.(3分)(1)用锅盖盖灭;(2)6HCl+2Al(OH)3=2AlCl3+6H2O;(3)增大;
43.(4分)(1)8;(2)17;(3)Ca2+,(4)(NH4)2SO4等。
44.(5分)(1)H2O,NH3;(2)Fe2O3+3CO=2Fe+3CO2;(3)Fe2O3+6HCl=2FeCl3+3H2O;2FeCl3+Fe=3FeCl2。
三.(每空1分,共11分)
45.(1)镊子(或药匙),稀盐酸;(2)CaCO3+2HCl=CaCl2+CO2↑+H2O;(3)d,c a b d e;
46.(1)
| 实验一 | 时间较长、温度较高 2KClO3=2KCl+3O2↑ | ||
| 实验三 | 将MnO2与KClO3的混合物加热 |
(2)对比(或比照等);
(3)第一方面:比较MnO2在KClO3分解前后的质量;
第二方面:验证从反应后的剩余物中分离出的物质是否能加快KClO3的分解。
四.(10分)
47.(4分)
解:(1)钾肥中钾元素与硫元素与氧元素的质量比为:39︰16︰32(2分)
(2)K%=钾元素的相对原子质量之和/K2SO4的相对分子质量=2×39/174×100%=44.9% (2分)
48. (6分)
解: (1)由图可知,生成BaSO4沉淀的质量为23.3g (1分)
(2)设BaCl2的质量为x,生成NaCl的质量为y
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
208 233 117
X 23.3g y
x=20.8g (1分)
y=11.7g (1分)
溶液的总质量=29.1g + 94.2g + 100g -23.3g=200g (1分)
溶质的总质量=11.7g + (29.1g—20.8g)=20g (1分)
NaCl%=20/200×100%= 10% (1分)
答:生成沉淀23.3g,所得NaCl溶液的质量分数为10%。
(注:其他解法,只要合理,结果正确,均可给分。)