扬州市2005年初中毕业、升学统一考试化学试题
(考试时间:90分钟 满分100分)
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 | 积分人 | 核分人 |
| 得分 |
可能用到的相对原子质量:
H:1 C:12 O:16 Na:23 Cu:64 Zn:65
| 得分 | 评卷人 |
一、选择题(本题共17小题,每小题2分,共34分,每小题只有一个选项符合题意,将它的编号填入下表对应的空格中。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 |
1.下列食品、调味品的制作过程中,没有发生化学变化的是
A.鲜奶制酸奶 B.水果榨果汁
C.糯米酿甜酒 D.黄豆酿酱油
 2.2004年我市荣获“中国人居环境奖”。为保护我市优美的环境,促进经济可持续全面发展,你认为可向市政府提出的建议是
2.2004年我市荣获“中国人居环境奖”。为保护我市优美的环境,促进经济可持续全面发展,你认为可向市政府提出的建议是
A.大力发展燃油汽车的数量,提高城市现代化程度
B.加快烟草事业的发展,增加国家的税收
C.采用“绿色化学”工艺,使工业原料尽可能转化为所需要的物质
D.推广使用卫生的一次性发泡塑料餐具,方便居民生活
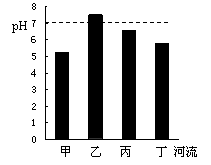 扬州里下河地区河流众多,某化学兴趣小组用洁净的塑料瓶分别从甲、乙、丙、丁四条河流中,取回一定量的水样进行研究。请回答3~6题:
扬州里下河地区河流众多,某化学兴趣小组用洁净的塑料瓶分别从甲、乙、丙、丁四条河流中,取回一定量的水样进行研究。请回答3~6题:
3.经测定,甲、乙、丙、丁四条河流的pH如图所示,则河水呈碱性的河流是
A.甲 B.乙 C.丙 D.丁
4.在老师的指导下,他们还测定出水样中含有氮、磷、钠等,这里的氮、磷、钠是指
A.元素 B.分子 C.原子 D.单质
5.为测定水样中氯离子含量,需2 %的硝酸银溶液。若用硝酸银晶体配制100 g该溶液,需加水
A.48 g B.49 g C.98 g D.99 g
6.上述溶液配制过程中,在用量筒取水时仰视读数(其它过程均正确),则所配溶液溶质的质量分数
A.偏大 B.偏小 C.无影响 D.无法确定
7.汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是
A.氧气 B.二氧化碳 C.稀有气体 D.氮气
8.铁制的菜刀在生产时要通过“粹火”处理来增加刀的硬度,具体操作是将红热的菜刀浸入水中急速冷却。此时发生反应如下3Fe+4H2O ==== Fe3O4+4H2↑该反应中属于还原剂的是
A.Fe B.H2O C.Fe3O4 D.H2
9.2005年中央电视台春节联欢晚会上,甘肃省向观众拜年的对联是:“金银铜铁铬镍铅锌”。针对此联,下列说法正确的是:
A.这八种元素单质颜色是相同的 B.这八种元素在自然界中均以单质形式存在
C.这八种元素单质均可与稀盐酸反应产生氢气 D.这八种元素都属于金属元素
10.木糖醇(C5H12O5)是一种广泛用于口香糖的防龋齿食品。下列有关木糖醇的说法不正确的是
|
B.该物质分子中碳、氢、氧原子个数比为5∶12∶5
C.该物质中碳、氢、氧三种元素的质量比为5∶12∶5
D.该物质的相对分子质量为152
11.钢铁在日常生产、生活中有广泛的用途,润扬长江公路大桥就用了16.3万多吨钢铁。下列家庭钢铁物品防锈措施无效的是
A.菜刀上撒盐水 B.铁栅栏表面刷油漆
C.自行车链条涂油 D.保持铁锅表面干燥
12.下列关于溶液的说法正确的是
A.溶液一定是无色透明的
B.溶质一定是固体
C.温度不变时,不饱和溶液变成饱和溶液,其溶质的质量分数不一定增大
D.饱和溶液一定是浓溶液
13.下列实验现象的描述错误的是
A.硫在氧气中燃烧发出蓝紫色火焰
B.氯化铜溶液与氢氧化钠溶液混合有蓝色沉淀生成
C.石蕊试液滴入稀盐酸中,溶液呈红色
D.铁粉中加入稀硫酸,溶液显黄色
14.下列溶液暴露在空气中,溶液质量因变质而增大是
A.浓NaOH溶液 B.浓硫酸 C.浓盐酸 D.饱和NaCl溶液
15.能一次性鉴别澄清石灰水、稀盐酸和食盐溶液的试剂是
A.稀硫酸 B.碳酸钠溶液
C.硝酸银溶液 D.氯化钡溶液
16.下列除杂的实验过程都正确的是(括号内为杂质)
A.MnO2 (KCl) 加水溶解、过滤、蒸发、结晶
B.BaSO4(BaCO3) 加足量稀盐酸、过滤、洗涤、干燥
C.CuO(Cu) 加足量稀盐酸、过滤、洗涤、干燥
D.KCl(K2CO3) 加足量稀盐酸、过滤、蒸发、结晶
17.某化学兴趣小组设计了四套实验方案,来证明固体炭粉中是否含有氧化铜。其中可行的是
A.在样品中加水,是否有蓝色沉淀
B.在样品中加稀硫酸,充分反应后,是否有固体剩余
C.在空气中充分加热样品,恢复到原温度后,固体质量是否减小
D.在样品中加稀硫酸,充分反应后,溶液是否呈蓝色
| 得分 | 评卷人 |
二、选择题(本题共5小题, 10分。每小题有1~2个选项符合题意,请将它的编号填入下表对应的空格中。错选、多选均不得分,漏选给1分。)
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
18.某溶液能与镁反应生成氢气,则下列各组物质在该溶液中能大量存在的是
A.KCl、NaCl、Na2SO4 B.NaCl、NaNO3、AgNO3
C.Na2CO3、NaCl、Na2SO4 D.HCl、NaCl、Na2SO4
19.类推是化学学习中常用的思维方法。下列类推结果正确的是
A.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
B.酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应
C.燃烧一般都伴随发光、放热现象,所以有发光、放热的现象就是燃烧
D.水能使无水硫酸铜变蓝,所以能使无水硫酸铜变蓝的就是水
20.在一个密闭的容器内有四种物质,高温下发生反应,一段时间后测得反应前后各物质的质量如下:
| A | B | C | D | |
| 反应前质量(g) | 8 | 10 | 1 | 25 |
| 反应后质量(g) | 未测 | 24 | 2 | 16 |
若A的相对分子质量为2n,D的相对分子质量为3n,则该反应的化学方程式中A与D的化学计量数比为:
A.1∶1 B.1∶2 C.1∶3 D.2∶3
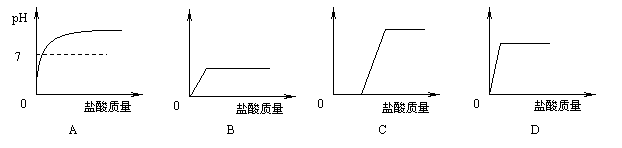 |
21.取实验室中部分变质的NaOH样品配成溶液,向其中滴加过量的稀盐酸。下列示意图能正确反映其中变化的是
22.有一管道煤气可能含H2、CO、CO2中的两种或三种,现将该煤气依次通过足量的灼热的氧化铜、固体NaOH。若每步反应都完全,反应后氧化铜固体质量减少1.6 g,固体NaOH增重2.8 g,则煤气可能组合中含H2质量最少的一组是
A.H2、CO、CO2 B.H2、CO C.H2、CO2 D.CO、CO2
| 得分 | 评卷人 |
三、填空题(本题共7小题, 共32分)
 23.当X值不同值时,微粒结构示意图
可表示不同的粒子。用元素符号各写出一种该图表示的原子 、阳离子 、阴离子 。
23.当X值不同值时,微粒结构示意图
可表示不同的粒子。用元素符号各写出一种该图表示的原子 、阳离子 、阴离子 。
24.家庭厨房实际上就是一个化学世界,“柴米油盐酱醋糖”等都是化学物质。请问:
(1)加碘食盐所含碘酸钾(KIO3)中,I元素化合价是 。
(2)白糖与红糖,主要成分都是蔗糖。利用活性炭的 性,可将红糖脱色变成白糖。
(3)食醋不慎滴在大理石台面上,会使其失去光泽,变得粗糙。这是因为食醋中的 (填化学式)与大理石发生了化学变化。
 (4)明年我市部分家庭厨房中的“柴”将被“西气东输”工程送来的“天然气”所替代,写出天然气主要成份的化学式 。
(4)明年我市部分家庭厨房中的“柴”将被“西气东输”工程送来的“天然气”所替代,写出天然气主要成份的化学式 。
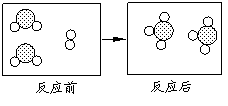 25.甲、乙、丙三种固体物质的溶解度曲线如右图所示,由图可知: 物质的溶解度随温度升高而减小;t1℃时 物质的溶解度最大;t2℃时,甲、乙两种饱和溶液溶质的质量分数
(填“相等”、“不相等”、“不一定”);当甲中含有少量乙时,可以用 法(填“降温结晶”、“蒸发结晶”、“过滤”)提纯甲。
25.甲、乙、丙三种固体物质的溶解度曲线如右图所示,由图可知: 物质的溶解度随温度升高而减小;t1℃时 物质的溶解度最大;t2℃时,甲、乙两种饱和溶液溶质的质量分数
(填“相等”、“不相等”、“不一定”);当甲中含有少量乙时,可以用 法(填“降温结晶”、“蒸发结晶”、“过滤”)提纯甲。
26.![]()
![]() 下图形象地表示了在加热催化剂条件下,某化学反应前后反应物与生成物分子及其数目的变化,其中 表示硫原子, 表示氧原子,则该反应的化学方程式为
下图形象地表示了在加热催化剂条件下,某化学反应前后反应物与生成物分子及其数目的变化,其中 表示硫原子, 表示氧原子,则该反应的化学方程式为
27.小明同学在“六一”儿童节上为小朋友表演了精彩的化学魔术。他在一张白纸上用“清水”写上“祝小朋友节日快乐”字样,结果白纸上出现了红色的字迹,他再将另一种“清水”喷在白纸上,红色的字迹又消失了。你能告诉我们:原来白纸上可能含有 ,写字的“清水”可能是 溶液,后来喷的“清水”可能是 溶液。
28.今年5月,我国科考队在重测珠穆朗玛峰高度时,发现由于全球气温升高,珠峰冰川消融区面积不断扩大。大自然又一次发出的警告:地球正在变暖!温室效应的影响已经不容忽视。研究表明,大气中二氧化碳的含量增大是引起温室效应的主要原因。
(1)造成大气中二氧化碳的含量增大的主要原因是
。
(2)为了减缓温室效应,我们每个人都要从自己身边做起,比如说拒绝纸质贺卡,使用电子贺卡。拒绝纸质贺卡和减缓温室效应之间的关系是
。
(3)请再举出一件你可以做到的有利于减缓温室效应的事情 。
(4)科学家采取“组合转化”技术,将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料X和水,其反应式为:CO2+3H2=X+H2O。化工原料X的化学式为 。
(5)中国科技大学的研究成果“低温还原二氧化碳合成金刚石”,其原理是在440 ℃和8.08×107 Pa的条件下,用金属Na和CO2反应生成金刚石。在一般条件下,金属Mg在CO2中燃烧,所发生的反应与上述原理上致。写出金属Mg在CO2中燃烧的化学方程式 ,该反应所属基本反应类型是 反应。如果实验室金属Mg着火,可选用的灭火剂是 (填字母) A.液态二氧化碳灭火器 B.沙子
29.某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料。某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐。如光卤石(KCl·MgCl2·6H2O))。
试回答下列问题:
(1)写出下列物质的化学式:C 、E 、 F
(2)写出下列变化的化学方程式:
② ③

(3)上述探究结果说明样品A中含有的离子有
。
| 得分 | 评卷人 |
四、实验题(本题共2小题, 18分)
 |
30.根据实验装置图,回答下列问题:
(1)实验室若用排空气法收集氧气可选用 装置(用编号回答,下同);用KMnO4制氧气的反应方程式为
(2)氢气还原氧化铜的实验可选 装置;实验时发现试管破裂,分析其中原因可能是 。
(3)实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。选用 装置制取甲烷,收集气体时可选用 或 。
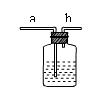
(4)右图是某学生设计的一种有洗气、贮气等用途的装置。
欲除去O2中混有的水蒸气,瓶中可盛 ;当用排水集气法收集氢气时,瓶内先装满水,气体从 (填“a”或“b”,下同)处导管通入。若要用水将瓶中氢气排出使用,水应从 处导管进入。请再举出该装置的一种用途 。
31.小明同学在学习酸的性质时,他用大小、外形均相同的铝片分别和H+浓度相同的稀盐酸、稀硫酸反应。他意外地发现:铝片与稀盐酸反应放出气泡的速度明显快于与稀硫酸反应放出气泡的速度。是什么原因导致了反应现象的差异呢?小明从微观角度分析得出,H+浓度相同的盐酸、硫酸中,只是所含 不同。
小明提出了如下猜想:
①Cl— 能促进铝和酸的反应,SO42— 对反应无影响;
②Cl— 对反应无影响,SO42— 能抑制铝和酸的反应;
③Cl— 能促进铝和酸的反应,SO42— 能抑制铝和酸的反应;
他进行了如下实验探究:
| 组别 | 相同的铝片 | H+浓度相同的酸 | 反应片刻后添加某种试剂(少量) | 添加试剂后的反应现象 | 结论 |
| 1 | 1g铝片 | 5mL盐酸 | Na2SO4 | 无明显变化 | 和 离子对反应无影响 |
| 2 | 1g铝片 | 5mL硫酸 | NaCl | 明显加快 | 离子对反应有促进作用 |
针对上述探究过程回答下列问题:
(1)请你将表格中的空格补充完整;
(2)上述猜想 是成立的;
(3)若将第2组实验中添加的试剂NaCl改为HCl气体,能否完成探究任务?请说明原因。
| 得分 | 评卷人 |
五、计算题(本题共1小题,6分)
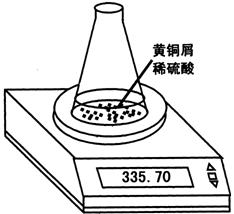
32.某学习小组用图示装置测定黄铜屑(锌铜合金)的组成,取一定量的黄铜屑放入烧杯中,并加入足量稀硫酸。不同时间电子天平的读数如下表所示(不考虑H2O逸出):
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 烧杯及所盛 物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(1)反应生成H2的总质量为 g。
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是 ,
若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程)。
扬州市2005年初中毕业、升学统一考试化学试题评分标准
【评卷说明】
1.所有专业术语、化学用语(符号、化学式等)错误均不给分。
2.化学方程式未配平不给分。
3.文字表达只要答到关键词即可得分。
4.答题中其它合理的说法和解法均可得分。
一、选择题(本题共17小题,每小题2分,共34分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | B | A | C | B | D | A | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 | C | A | C | D | C | B | B | D |
二、选择题(本题共5小题, 10分。每小题有1~2个选项符合题意,请将它的编号填入下表对应的空格中。若只有一个正确选项的,多选不给分;若有两个正确选项的,选对一个给1分,选错一个就不给分。)
| 题号 | 18 | 19 | 20 | 21 | 22 |
| 答案 | AD | D | A | CD | B |
三、填空题(本题共7小题,共32分。除化学方程式为2分外,其它每空1分。)
23.(3分)Ne;Na+、Mg2+、Al3+(任写其中一种都得分);F-、O2-、N3- (任写其中一种都得分)
24.(4分)(1)+5(2)吸附(3)CH3COOH或C2H4O2(4)CH4
25.(4分)丙 乙 相等 降温结晶
|
27.(3分)酚酞(碱) 碱(酚酞) 酸 (写具体的酸、碱名称也可)
28.(8分)(1)大量化石燃料的燃烧,产生了更多的二氧化碳气体;能吸收二氧化碳的森林大量消失。(两点答任一点都可)
(2)节约纸张就可以节约造纸所消耗的能源,从而减少二氧化碳的排放。或节约纸张就可以减少造纸所消耗的木材,从而保护森林,吸收更多的二氧化碳。
(3)植树造林、不使用一次性木筷、节约用纸等。(只要答出一个即可)。
(4)CH3OH 或CH4O
|
29.(8分)(1)C:NH3 E:Fe(OH)3 F:BaSO4
(2)② 4Fe(OH)2+O2+2H2O ===== 4Fe(OH)3
③ Na2SO4+Ba(NO3)2===== BaSO4↓+2NaNO3
(3)Fe2+、NH4+、SO42-(少一个不得分)
四、实验题(本题共2小题,共18分。除化学方程式为2分外,其它每空1分。)
30.(12分)(1)E 2KMnO4![]() K2MnO4+MnO2+O2↑ (反应条件不写扣1分)
K2MnO4+MnO2+O2↑ (反应条件不写扣1分)
(2)B 未预热或受热不均匀或试管未向下倾斜(答任一点都给分)
(3)A D F
(4)浓H2SO4 b a 检验气体
31.(6分)酸根离子;(1)Na+ SO42- ;Cl-
(2)①
(3)不能,由于HCl气体溶于水生成盐酸,增加了溶液中H+浓度,实验条件发生了变化。
32.(6分)(1)反应生成H2的总质量:335.70 g-335.30 g = 0.4 g …………………………………(2分)
(2)黄铜屑的总质量 … …………………………………………………………(1分)
设Zn的质量为x
Zn+H2SO4======ZnSO4+H2↑ ……………………………………………………………(1分)
65 2
x 0.4 g
![]() X= 13 g …………………………………………………………………(1分)
X= 13 g …………………………………………………………………(1分)
黄铜屑中锌的质量分数:![]() …………………………………………………………(1分)
…………………………………………………………(1分)
