2006年江苏省淮阴中学中考化学预测试题
相对原子质量:H:1 C:12 O:16 Fe:56 Cl:35.5 Ca:40 Cu:64 S:32 Ba:137 N:14
一、单项选择题(每题2分,共40分,将答案填在对应的题号下面)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
1.下列诗句包含化学变化的是
A.粉身碎骨浑不怕,要留清白在人间。(《石灰吟》)
B.欲渡黄河冰塞川,将登太行雪满山。(《行路难》)
C.气蒸云梦泽,波撼岳阳城。(《望洞庭湖赠张丞相》)
D.忽如一夜春风来,千树万树梨花开。(《白雪歌送武判官归京》
2. 下列现象中,没有直接利用化学反应所产生能量的是
A. 人用食物维持体能B. 家庭用煤气做饭 C. 办公室用空调取暖 D. 用炸药拆除建筑
3.下列物质中属于混合物的是
A.硫酸铜 B.冰水共存物 C.玻璃 D.干冰
4.在反应SO3+H2O==H2SO4中,反应前后发生改变的是
A.分子总数 B.原子总数 C.质量总和 D.质子总数和中子总数
5.“摇摇冰”是一种即用即冷的饮料,吸食时,只要将饮料罐隔离层中的物质与水混合后摇动,即可制冷。该物质可能是
A.氯化钠 B.硝酸铵 C.氢氧化钠 D.生石灰
6.室温下,饱和食盐水露置在空气中一段时间后,有少量的固体析出,这是因为
A.氯化钠的溶解度变小 B.溶液质量分数变小C.溶剂质量减少D.溶液变为不饱和溶液
7.我国“神舟五号”宇宙飞船飞行试验成功,运载“神舟五号”飞船的火箭所使用的燃料是偏二甲肼(化学式为C2H8N2)。下列关于偏二甲肼的说法正确的是
A.偏二甲肼是由碳、氢、氮三种元素组成的 B.偏二甲肼中含有氮气
C.偏二甲肼的相对分子质量是52 D.偏二甲肼中碳、氢、氮的质量比为1:4:1
8.已知金属M(只有一种化合价),氧化物的化学式为M2O3,则它的氯化物的化学式为
A.MCl3 B.MCl2 C.M2Cl3 D.MCl
9.当水的温度和压强升高到临界点(t=374.3℃ P=22.5MPa)以上的时候,就处于一种既不属于气态,也不属于液态和固态的新流体态—超临界态,该状态的水称之为超临界水。一些有机废物(如:二恶英等)和空气、氧气等氧化剂可在超临界水中快速氧化,使有害物质充分转化为二氧化碳、氮气、水以及盐类等无毒小分子化合物。判断下列说法错误的是
A.超临界水氧化技术可用于治理污染 B.超临界水是一种优良溶剂
C.超临界水是一种不属于水的新物质 D.超临界水是水的另一状态
10.电解水实验的过程中,当有一半的水被电解时,下列数值关系错误的是
A.生成的氢气、氧气的质量比为l:8 B.生成的氢气、氧气的体积比为2:1
C.这时水的质量等于生成的氢气和氧气的质量之和
D.这时水的体积等于生成的氢气和氧气的体积之和
11.我国正在推广使用乙醇汽油。所谓乙醇汽油就是在汽油中加入适量乙醇(一般为9:1)混合而成的一种燃料。下列有关的叙述错误的是
A.乙醇汽油是一种新型的化合物 B.汽车使用乙醇汽油可以减少有害气体的排放
C.由石油可以制得汽油 D.由玉米、高梁发酵可以制得乙醇
12.某气体可能由O2、CO2、CO中的两种或三种气体组成。经测定该混合气体中碳、氧两种元素的质量比为1∶2,则该混合气体的组成不可能的是
A.CO2、CO B.O2、CO2 C.O2、CO D.O2、CO2、CO
13.下列有关生活经验的说法错误的是
A.刀片上涂油可防止生锈 B.用汽油可洗去衣服上的油渍
 C.用食醋可除去热水瓶内的水垢 D.经常用钢丝球洗刷铝锅可延长使用寿命
C.用食醋可除去热水瓶内的水垢 D.经常用钢丝球洗刷铝锅可延长使用寿命
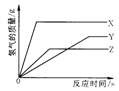
14.某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用右图来表示。下列对该图象理解的叙述中,正确的是
A.金属活动性由强到弱: Z、Y 、X
B.金属活动性由强到弱:X、Y、Z
C.X、Y、Z依次可能是Mg、Zn、Fe D.相对原子质量的大小:Z>Y>X
15.下列有关溶液的说法正确的是
A.均一、稳定的液体不一定是溶液 B.稀溶液一定是不饱和溶液
C.温度升高,固体的溶解度增大 D.食盐的饱和溶液一定比不饱和溶液浓
| 物质 | X | Y | Z | Q |
| 反应前质量 | 4g | 10g | 1g | 21g |
| 反应后质量 | 0g | 12g | 15g | 待测 |
16.在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如右表所示:已知X的相对分子质量为n,Q的相对分子质量为2n, 则下列推断正确是
A.反应中Y和Q的质量比为1:1 B.反应后Q的质量为12g
C.反应后生成15g Z D.该反应化学方程式中X与Q的化学计量数之比为2:3
17.常温下,质量为5g的下列物质放入95g水中,所得溶液的溶质的质量分数最小的是
A.蔗糖 B.硫酸铜晶体 C.氯化钠固体 D.氢氧化钙
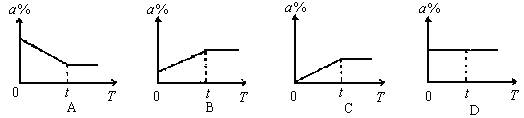
18. 下列图像中能表示过氧化氢和二氧化锰制氧气时,二氧化锰在反应混合物中的质量分数(a%)随时间(T)变化的曲线图是(t时表示反应已完全)
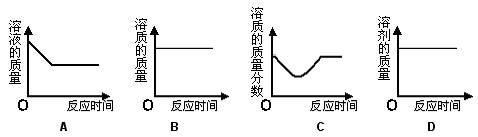
19.将一定质量的生石灰加到一定质量饱和澄清石灰水溶液中,从开始到反应结束的过程中,温度先升高到最高温度后又恢复到原来温度,则下列关于溶液的分析正确的是
20.常用燃烧法测定有机物的组成。现取2.3 g某有机物在足量的氧气中完全燃烧,生成
4.4 g CO2和2.7 g H2O。对该物质的组成有下列推断:①一定含C、H元素 ②一定不含
O元素 ③可能含O元素 ④一定含O元素 ⑤分子中C、H的原子个数比为2:5 ⑥分
子中C、H、O的元素质量比为12:3:8。其中正确的是
A.①②⑤ B.①④⑥ C.①③⑤ D.①④⑤
二、填空题
21.请用化学方法除去下列各组物质中括号中的物质,写出化学方程式,并标明反应类型。
(1)铜粉(铁粉)_______________________________________________( );
(2)生石灰(石灰石)___________________________________________( );
(3)二氧化碳(氧气)_______________________________________( );
(4)氯化钠(碳酸钠)_______________________________________;
(5)一氧化碳(二氧化碳)_______________________________________;
22.在碳、一氧化碳、二氧化碳、氧气四种物质中,每一种物质都有不同于其他三种物质的特点,例如:碳:常温常压下是固体,其他三种物质是气体。请根据示例,填空:
(1)一氧化碳:____________________________________________;
(2)二氧化碳:____________________________________________;
(3)氧气:________________________________________________。
23.某兴趣小组为验证鱼骨的成分,把鱼骨放在酒精灯上充分煅烧,得到白色固体,冷却后研成粉末,再向白色粉末中加入足量的稀盐酸,有能使澄清石灰水变浑浊的气体产生。请回答:
⑴鱼骨中被烧掉的物质是 ;
⑵已知动物的骨骼中含有Ca2+,则鱼骨中至少含有的物质是 ;
⑶下列说法中错误的是( )
 A.鱼骨放入稀盐酸中浸泡会变软
A.鱼骨放入稀盐酸中浸泡会变软
B.饮用牛奶可补充钙质
C.骨质疏松患者不宜补钙
D.骨酸能促进钙质的吸收
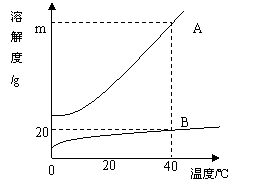
24.如图为A、B两种固体物质的溶解度曲
线。试根据下图回答问题。
(1)在同一温度下,A和B能不能配制成质
量分数相同的饱和溶液? ,
理由是 。
(2)在40℃时,60gA的饱和溶液与60gB
的饱和溶液中,A与B的质量比为3:1,则m= .
25.啤酒、红酒和白酒中都含有乙醇(C2H5OH),、饮酒后乙醇可进入人体血液中,科学实验表明,当乙醇在人体血液中的含量超过80mg/100mL血(每100mL血中含有80mg乙醇)时,便会影响人的驾车或操作机器的能力;已知饮用某啤酒l大杯(0.56L),会使血液中乙醇含量升高30mg/100mL血。回答下列问题:
(1)某位汽车驾驶员饮用了3大杯上述啤酒后,其体内每100mL血液中乙醇的含量(理论上)升高了 mg/100mL血。
(2)如该位驾驶员饮用上述量的啤酒后驾驶汽车, (选填“影响”或“不影响”)其驾车的能力。
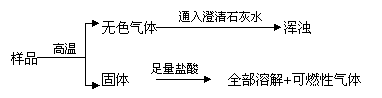 26、有一包粉末,可能含有碳酸钙、氧化铜、氧化铁、炭粉中的一种或几种,先作如下实验:
26、有一包粉末,可能含有碳酸钙、氧化铜、氧化铁、炭粉中的一种或几种,先作如下实验:
据此判断:粉末中一定含有_______;一定不含有_________;可能含有________,若要证明它的存在,可在样品中滴入________,此反应的化学方程式为
三、简答题
27、 有A、B、C、D四种元素,已知A元素的原子是自然界中质量最小的原子;B元素的常见单质占空气体积的21%;C元素的一种单质是天然物质里硬度最大的晶体;D元素以化合态广泛存在于石灰石等矿物中,它的阳离子带有两个单位的正电荷。请回答:
(1)A元素的单质的化学式是___________;D元素的阳离子的符号是__________;B元素所形成的常见单质的一种用途是_________________________________。
(2)由CB2转化为DCB3的化学方程式是_________________________________。
28.试简答或解释下列生活现象:
(1)春暖花开的季节里,人们在公园常能闻到怡人的花香气味,这说明
。
(2)为了便于运输和使用,通常将石油气加压变成液态储存在钢瓶中。这一事实说明
。
(3)秸秆、煤炭、棉纱等,如果堆放不合理,空气不流通,时间长了就可能引起 。
(4)维生素C在酸性环境中比较稳定,受热时易被破坏,因此采用 的食用方法,才能充分利用黄瓜中丰富的维生素C。
(5)去年12月30日苏州降大雪,近千环卫职工冒着严寒深夜向桥梁的上下坡抛撒数吨工业用盐,请简述向积雪或冰面撒盐是为了
的缘故。
四、实验题
29根据下表填空
| 气体 | 二氧化氮 |
|
| 颜色 | 棕色 | 无色 |
| 溶解性 | 易溶于水 | 微溶于水 |
| 反应 | 3NO2+H2O==2HNO3+NO | |
(HNO3,即硝酸,是化学常见的强酸之一,易溶于水)
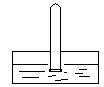
如右图所示,将一支充满二氧化氮的棕色气体的试管倒立在水槽中,试描述试管内可能出现的实验现象。
①________________________________②_______________________________。
30.某学习小组为探究金属的性质,将一根铝条放入盛有稀盐酸的试管中,实验现象记录如下:
| 反应时间/min | 1 | 5 | 8 | 10 | 13 | 15 |
| 实验现象 | 少量 气泡 | 较多 气泡 | 大量 气泡 | 反应 剧烈 | 少量 气泡 | 反应停止 铝条剩余 |
试解释上述实验过程中,产生一系列现象的原因:
。
 31、实验室提供以下所示的常见仪器,供完成下列气体制取实验时选用。
31、实验室提供以下所示的常见仪器,供完成下列气体制取实验时选用。
(1)写出下列仪器的名称:A B D H
(2)实验室采用加热高锰酸钾制取O2并用排水法收集O2时,必须选用上述仪器中的 (填序号),反应化学方程式为为 。
(3)过氧化氢(H2O2)俗称双氧水,常温下是一种无色液体,它在二氧化锰的催化作用下能迅速分解,生成水和氧气。写出该反应的化学方程式 。若实验室采用该反应来制取O2,并且在实验过程中可以随时添加双氧水,则气体发生装置必须选用上述仪器中的
(填序号)。
 (4)氨气(NH3)是一种密度比空气小,极易溶于水的气体,实验室常用固体NH4Cl和固体Ca(OH)2加热制得NH3,同时得到氯化钙和水,该反应的化学方程式为
,实验制取和收集NH3必须选用上述仪器中的
(填序号)。
(4)氨气(NH3)是一种密度比空气小,极易溶于水的气体,实验室常用固体NH4Cl和固体Ca(OH)2加热制得NH3,同时得到氯化钙和水,该反应的化学方程式为
,实验制取和收集NH3必须选用上述仪器中的
(填序号)。
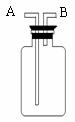
(5)若直接使用右图所示装置收集O2,
O2由 口进入;若在装置中充满水,则
O2应由 口进入(填编号)。
32.用含有二氧化碳和水蒸气杂质的某种还原性气体测定一种铁的氧化物(FexOy)的组成,实验装置如图所示。
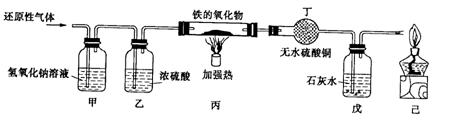
(1)甲装置的作用是 ,反应的化学方程式是 .
(2)如果将甲装置和乙装置位置的顺序调换,对实验 (填有或无)影响
(3)实验过程中丁装置中没有明显变化,而戊装置中溶液出现了白色沉淀,则该还原性气体是 ;
(4)当丙装置中的FexOy全部被还原后,称量剩余固体的质量为16.8g,同时测得戊装置的质量增加了17.6g,则FexOy中,铁元素和氧元素的质量比为 ,该铁的氧化物的化学式为 。
(5)上述实验装置中,如果没有甲装置,将使测定结果中铁元素与氧元素的质量的比值
(填“偏大”、“偏小”或“无影响”);如果没有己装置,可能产生的后果是 。
五、计算题
33.将10g不纯的锌粒(杂质不溶于水也不溶于酸)投入到100g稀硫酸中完全反应,得到了0.2g气体。试计算:
(1)锌粒的纯度;
(2)参加反应的稀硫酸的质量分数;
(3)反应得到的溶液的溶质质量分数;
(4)如果我们要用98%的浓硫酸来配制500g反应使用的稀硫酸,需要浓硫酸多少毫升?水多少毫升?(浓硫酸的密度为1.84g/mL)
34.甲、乙、丙三个同学用下列试剂分进行实验,均恰好反应完全。所用试剂及质量见下表:

已知a1+a2+a3=21.9,b1+b2+b3=182.5,现将甲、乙、丙三位同学所得溶液全部倒入一容器内,称得此溶液质量为200g。
试求:⑴a3,b3的值;
⑵此混合溶液中溶质的质量分数。(精确到0.1%)
答 案
1.A 2. C 3.C4.A5.B. 6. C 7.A.8.A9.C.10.D11.A.12. B
13.D.14. D.15.A 16.D 17.D18. B19.C 20.B
21.Fe+2HCl=FeCl2+H2↑ 置换反应 CaCO3 高温=CaO+CO2↑ 分解反应
![]() 化合反应 Na2CO3+2HCl=2NaCl+
H2O+ CO2↑
化合反应 Na2CO3+2HCl=2NaCl+
H2O+ CO2↑
CO2+2NaOH= H2O + Na2CO3
22 (1)有剧毒,其他三种物质无毒;
(2)能使澄清石灰水变浑浊,其他三种物质不能;
(3)能供呼吸,其他三种物质不能。
23.⑴有机物 ⑵CaCO3 ⑶C
24.(1)不能 A、B的溶解度在任何温度时都不相同。 (2)100g
25. (1)90 ,(2)影响
26.C 、Fe2O3 CuO CaCO3 稀盐酸 CaCO3+2HCl=CaCl2+H2O+CO2↑
27、(1)![]() ;
;![]() ;急救病人,支持燃烧,登山潜水
;急救病人,支持燃烧,登山潜水
(2)![]()
28.(1)物质的微粒在不停地运动。
(2)石油液化气微粒之间存在着空隙,当压强增大后,微粒之间的空隙减小。
(3)自燃。
(4)凉拌加醋
(5)形成溶液后,溶液的凝固点下降,加快积雪的融化。
29.水面上升 棕色消失
30.铝易被空气中的氧气氧化,在铝条表面有一层致密的氧化物保护膜。将铝条放入稀盐酸中,稀盐酸与铝条表面的氧化铝反应,所以气泡较少。随着氧化铝的减少,铝与盐酸接触面增大,气泡逐渐增加并达到反应最快。后来盐酸质量分数越来越小,反应速率减慢,直至停止。
31、(1)A、烧杯 B、试管 D、长颈漏斗 H、酒精灯
(2)B、C、E、G、H(2分,多选不给分,漏选酌量给分,下同)
2KMnO4 △ K2MnO4+MnO2+O2↑
(3)2H2O2![]() 2H2O+O2↑ B、D、E(或F、D)(2分)
2H2O+O2↑ B、D、E(或F、D)(2分)
(4)2NH4Cl+Ca(OH)2 △ CaCl2+2H2O+2NH3↑ B、C、E、H(2分)
(5)A、B
32. (1)吸收杂质二氧化碳;2NaOH+CO2![]() Na2CO3+H2O (2)有影响 (3)CO (4)21:8;Fe3O4 (5)偏小;污染空气,严重时使人中毒,甚至死亡。
Na2CO3+H2O (2)有影响 (3)CO (4)21:8;Fe3O4 (5)偏小;污染空气,严重时使人中毒,甚至死亡。
33. 解:设反应的锌粒质量为x,参加反应的稀硫酸溶质质量为y,反应后生成的硫酸锌质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
x y z 0.2g
![]()
![]()
![]()
⑴锌粒的纯度=![]()
⑵参加反应的稀硫酸的质量分数=![]()
⑶反应得到的溶液的溶质质量分数=![]()
⑷设需要浓硫酸的体积为a
a×1.84g/ml×98%=500g×15.1% a=41.87ml
V(H2O)=![]()
答:略
34.⑴a3 =10 ;b3=73 ⑵13.9%
 一氧化氮
一氧化氮