连云港市2005年初中毕业、升学统一考试
化学试题
本试题分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间100分钟
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Mg-24 Al-27 P-31
S-32 Cl-35.5 K-39 Ca-40 Mn-55 Fe- 56 Zn:65
第Ⅰ卷(选择题 共40分)
| 得分 | 评卷人 |
一、选择题(每小题只有一个选项符合题意。第1至4题每题1分,第5至22题每题2分,共40分,将它的编号填入下表对应的空格中)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
1.下列物质的用途与其物理性质有关的是
A.用生石灰作某些食品的干燥剂 B.白炽灯泡里涂上红磷作脱氧剂
C.用碳素墨水写文字档案便于保存 D.用活性炭除去冰箱异味
2.继“分子足球”C60之后,科学家又发现另一种“分子足球”N60。一定条件下N60中积累的巨大能量会在一瞬间释放出来,是未来的火箭燃料,N60属于
A.金属单质 B.非金属单质 C.化合物 D.混合物
3.今年5月21日至27日是全国第五届科技活动周,其主题是——保护生态环境,共建美好家园。下列做法有利于环境保护的是
①市区禁止摩托车通行 ②含汞电池集中处理 ③使用无铅汽油 ④不滥用塑料制品
⑤使用无氟冰箱 ⑥使用无磷洗衣粉 ⑦制止农民在田间焚烧农作物秸杆
A.①③⑤ B.②④⑥ C.③④⑦ D.①②③④⑤⑥⑦
4.下列家庭小实验不能成功的是
A.用食盐水除去菜刀表面的铁锈 B.用玻璃杯、口罩、筷子做粗盐提纯实验
C.用食醋鉴别食盐和纯碱 D.用铅笔芯的粉末使锁的开启更灵活
5.铁是一种应用广泛的金属。下列有关铁的叙述正确的是
A.从历史上看,人类利用最早的金属是铁器 B.用铁锅炒菜可使食物中增加微量铁元素
C.铁与盐酸反应可生成氯化铁和氢气 D.用于炼铁的铁矿石中含有大量的单质铁
6.今有四种粒子的结构示意图,下列说法正确的是
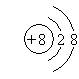
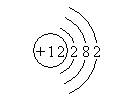
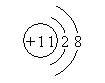
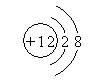
① ② ③ ④
A.它们表示四种元素 B.②表示的元素在化合物中通常显+2价
C.④表示的元素是非金属元素 D.①④表示的是阳离子
7.关于CO和H2的说法中,不正确的是
A.它们都难溶于水 B.它们都有可燃性和还原性
C.在相同状况下,它们的密度都比空气小
D.在加热时,它们都能和氧化铜发生置换反应
8.下列叙述正确的是
①分子是保持物质性质的一种微粒 ②原子是不能再分的一种微粒 ③有单质生成的反应一定是置换反应 ④生成两种化合物的反应一定是复分解反应 ⑤含有氧元素的化合物一定是氧化物 ⑥由不同种元素组成的纯净物一定是化合物
A.①③④ B.②③⑥ C.⑥ D.④⑤⑥
9.已知一种碳原子(质子数、中子数均为6)的质量为 a g,铝的相对原子质量为b,则一个铝原子的质量为
![]()
10.5角硬币的外观呈金黄色,它是铜和锌的合金,市面上有人用它制成假金元宝行骗,小明同学用一种试剂揭穿了他。小明一定不会用的试剂是
A.硫酸铜溶液 B.硝酸银溶液 C.盐酸 D.硝酸钠溶液
11.下列反应属于四种基本反应类型之一,且化学方程式完全正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
12.下列说法正确的是
A.可用胆矾检验市售无水酒精是否掺水
B.能和活泼金属反应放出氢气的物质一定是酸
C.高锰酸钾可作为氯酸钾分解的催化剂
D.配制12.5%硝酸钾溶液时,称量所用的砝码生锈,使实际配制的溶液中溶质质量分数偏大
13.向氧化铜和锌粉的混合物中加入一定量的稀硫酸,反应停止后过滤,再向滤液中插入铁片,铁片无变化。以下判断正确的是
A.滤液中一定含有铜和锌 B.滤液中一定含有Zn2+
C.滤液中一定含有铜 D.滤液中一定含有Cu2+
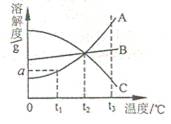
14.如图是 A、B、C三种固体物质(均不含结晶水)的溶解度曲线,根据图示,下列说法不正确的是
|
液中A的质量分数变大(假设升温时溶剂没有损失)
B.t1℃,将A、B、C各a g放入100g水中,充分搅拌,
所得溶液溶质质量分数均相等
C.t3℃时,取相同质量的A、B、C三种饱和溶液降温到t1℃,
析出晶体最多的是A,没有晶体析出并变成不饱和溶液的
是C
D.从A与少量C的混合物中提纯A,可用降温结晶的方法
15. 下列实验操作正确的是

16.最近部分品牌牙膏因含抗菌剂“三氯生”而可能致癌的消息成为媒体热炒的话题。已知“三氯生”的化学式为C12H7Cl3O2 ,关于它的说法不正确的是
A.该物质中碳、氢、氯、氧元素的质量比为12∶7∶3∶2 B.该物质属于有机物 C.该物质中含有碳、氢、氯、氧四种元素 D.该物质中碳元素的质量分数为49.7%
17.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | MnO2(KCl) | 水 | 溶解、过滤、结晶 |
| B | CO2(CO) | 氧气 | 点燃 |
| C | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| D | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
|
|
|
|
![]()
|
|
|
![]()
![]()
![]() C.Ba(OH)2 BaCl2 BaCO3 D.Mg MgSO4
Mg(OH)2
C.Ba(OH)2 BaCl2 BaCO3 D.Mg MgSO4
Mg(OH)2
19.将一定质量的CO和CO2的混合气体通入足量的石灰水中,充分反应后,生成的沉淀质量恰好等于原混合气体的质量,则原混合气体中CO和CO2的质量比为
A.14∶11 B.11∶14 C.7∶11 D.11∶7
20.下列各组溶液只用括号内试剂不能一次鉴别出来的是
A.硫酸铜、氯化镁、硝酸钾(石灰水) B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.醋酸、纯碱、食盐(酚酞试液) D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
21.质量相等的金属镁和铝分别加入质量相等、溶质质量分数相等的两份稀硫酸中,反应完毕后,金属均有剩余。则反应两种溶液质量关系是
A.相等 B.镁反应后的溶液质量大
C.铝反应后的溶液质量大 D.无法比较
22.下列四个图像分别对应四种操作过程,其中正确的是
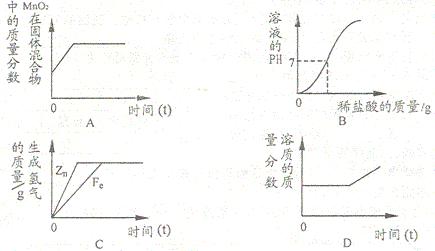
A.一定量的高锰酸钾加热制氧气
B.向一定量氢氧化钠溶液中逐滴加入稀盐酸
C.等质量的锌和铁分别和足量的溶质质量分数相同的稀硫酸反应
D.将烧杯中的饱和硝酸钾溶液恒温蒸发部分溶剂,再将烧杯中的物质逐渐升温(假设升温时溶剂没有损失)
第Ⅱ卷(非选择题 共60分)
| 总分 | 题号 | 二 | 三 | 四 | 五 | 六 | |
| 得分 |
考生注意:
1.答第Ⅱ卷前,考生务必将自己的姓名考试号、座位号填写在指定位置。
2.考生答题时只能用蓝色或黑色钢笔、圆珠笔将试题答案写在试卷规定的位置上,写在草稿纸上无效
二、填空题(本题包括5小题, 共19分)
23.(4分)用化学符号表示:
2个氮原子__________,3个铁离子_________,2个甲烷分子___________,胆矾__________。
24.(4分)从给定化合价的H、Na、O、N、S元素中,选择适当的元素组成符合下列要求的物质各一种,将其化学式填入相应的空格中:
⑴人体内含量最多的物质__________;⑵能与水反应生成强酸的氧化物_______________;
⑶具有强烈腐蚀性,广泛用于肥皂、造纸工业的化合物__________________________;
⑷一种常见的氮肥,且属于盐的是____________。
25.(3分)过氧化钠(Na2O2)是潜水艇氧气再生装置中制氧剂,它是一种淡黄色粉末,能与二氧化碳反应生成氧气,反应的化学方程式是![]() ,则Na2O2中氧元素化合价为__________,X的化学式为__________,反应后固体粉末变为_________色。
,则Na2O2中氧元素化合价为__________,X的化学式为__________,反应后固体粉末变为_________色。
26.(8分)酸碱反应与人们的日常生活和生产有密切的关系。
⑴由于人的胃里有_________,因此胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛。其治疗的化学原理为(用化学方程式表示)___________________________。
⑵做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加进适量的纯碱或小苏打等碱性物质,它们相互作用产生了__________气体(填化学式),使蒸出的馒头疏松多孔;若加入的碱性物质过多,可向面团或蒸锅中滴加少许含____________(填化学式)的酸性调味料,否则蒸出的馒头会变涩,颜色发黄。
⑶未成熟的水果大多具有涩味,这是因为水果里含有鞣酸。脱涩的方法之一是:先用少量的水将生石灰化成石灰乳,该变化的化学方程式是 ___________________________,然后把它用清水稀释,取上层清夜,浸泡水果5至6天即可除去涩味。
|
是由于昆虫在皮肤内注入了少量甲酸
所致。把少许右表所列的生活常用品
________或______(填编号)涂在被咬的皮肤上,痛痒便会消失。
⑸请你再举出一种生产、生活中常见的利用酸碱的例子_____________________________。
三、简答题(本题包括3小题, 共15分)
27.(6分)某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
⑴三次检测结果中第__________次检测结果不正确。
⑵在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的_______________溶液(填化学式),其目的是__________________;然后继续
加入过量的_____________溶液(填化学式),其目的是______________________;过滤
后,再向滤液中加入_____________溶液(填化学式)。
28.(3分)置换反应是化学反应的基本类型之一。
⑴金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来。如铜和硝酸银溶液的化学方程式为__________________________。
⑵非金属单质也具有类似金属与盐溶液之间的置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:
![]() ,
,![]() ,
,![]()
由此可判断:
①S、Cl2、I2、Br2非金属活动性由强到弱顺序是_______________________________。
②下列化学方程式书写错误的是______________________。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
29.(6分)有一包固体粉末,可能由Ba(NO3)2、NaCl、Na2CO3、CuSO4、CaCO3、NaOH中的一种或几种组成。现进行如下实验:
⑴取少量该粉末,向其中加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
⑵在上述沉淀中加入足量稀盐酸,沉淀全部溶解,并放出无色气体;
⑶用pH试纸测得⑴中无色滤液pH为14;
⑷取少量⑴中无色滤液,加入适量稀硫酸,无明显现象;
⑸另取少量⑴中无色滤液,加入稀硝酸和硝酸银溶液,无白色沉淀产生。
根据以上现象,判断该固体粉末的所有可能组成(可不填满,也可补充):
第一组_____________________________;第二组__________________________;
第三组_______________________________;……
四、实验题(本题包括2小题, 共12分)
30.(3分)实验课上,同学们设计以下三种方案均能达到实验目的各方案操作如下:
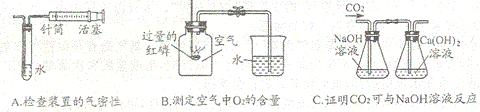
图A:向外拉注射器,若观察到__________________,说明装置气密性良好。
图B:点燃燃烧匙中过量的红磷,伸入集气瓶中充分反应后,打开弹簧夹,通过观察到_______________________________,可粗略测出空气中 O2的含量
图C:从左端导管处通入二氧化碳气体,开始观察到________________________________,证明CO2与NaOH溶液发生了反应。
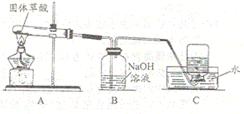
31.(9分)某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4·2H2O)受热可分解其化学
|
|
该课题小组的同学在实验室分别进行了如下实验
请回答下列问题:
⑴甲同学利用右图装置制取并收集CO:
①B装置的作用 ______________。
②CO集满后,将集气瓶由水槽中加盖取出,然后
先__________________,再_______________________________。
⑵乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、灼热的氧化铜、石灰水
你认为其中正确的方案是_________________。
⑶丙同学按下图装置利用草酸分解产生的CO测定某种铁的氧化物的组成。
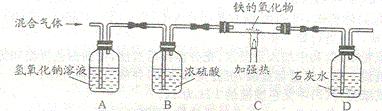
①当C装置中铁的氧化物全部被还原后,称量剩余的质量为a g,同时测的D装置的质量增加b g,则该铁的氧化物中铁元素和氧元素的质量比为_____________________。
②丁同学认为去掉A装置,对测定结果无影响,他的观点(填“正确”或“不正确”)你的判断理由是_____________________________________________________。而戊同学认为在D装置后还应再增加某装置,该装置的_______________________;若无此装置,对测定结果是否有影响?______________________(填“是”或“否”)。
五、综合题(本题共7分)
32.(7分)今年3月22日“世界水日”的主题是“与水共生”。水资源的保护和合理使用已受到人们的普遍关注,请回答以下相关问题:
⑴水厂生产自来水常用适量的氯气消毒,以杀死有害细菌,氯气是有刺激性气味的有毒气体,常温下能溶于水,溶解的氯气部分与水起反应,生成盐酸和次氯酸(HClO),次氯酸能杀死水里的病菌,也能使有机色素褪色。
①有些不法商贩用自来水冒充纯净水出售,为辨别真伪,可选用的试剂是___________。
A.酚酞试液 B.氯化钡溶液 C.硝酸银溶液 D.硫酸铜溶液
②某同学用滴管将饱和氯水加入到含有酚酞试液的烧碱溶液中,当滴到最后一滴时,红色突然褪去,红色褪去的原因有两种:一是__________________________________,
二是______________________________________________________________。
⑵近几年我国不少水域多次发生“赤潮”、“水华”现象,这是水中的藻类生长繁殖过快导致的水质恶化现象。
①已知藻类含有C134H243O110N16P的物质,则工业和生活污水中导致藻类生长过快的营养元素是___________(填名称)
②河水的微生物使有机物(假设以C6H10O5表示)转化成二氧化碳和水的过程所需氧气的量叫生化需氧量(简称BOD),BOD是衡量水体质量的一个指标。写出C6H10O5和氧气反应的化学方程式_______________________________________________。
某水质量监测站测得某河水段水体的BOD为7。2mg/L,该河段所含有机物的质量折合成C6H10O5为______________ mg/L
六、计算题(本题共7分)
33.(7分)现代生活中,人们越来越注意微量元素的摄入。血红蛋白中的铁是人体内氧的输送者,缺铁易患贫血。
⑴一种添加了营养剂的“铁强化”酱油已经面市。根据卫生部铁强化剂添加标准,每100ml酱油中铁营养剂添加量是200mg,该营养元素质量分数为12.5%。根据实验测得,酱油中铁只有10%能被人体吸收,以某人一天使用16ml该酱油计算,他一天从酱油中吸收的铁
元素是多少毫克?
⑵某贫血患者除正常饮食吸收铁元素外,还需服用含铁元素的某种药物。若治疗一个疗程需补充1.12铁元素,则服用药物中的铁元素相当于需要硫酸亚铁晶体(FeSO4·7H2O)多少克?
⑶若硫酸亚铁是由铁和稀硫酸反应制得,且反应后的溶液经过降温恰好完全转化为硫酸亚铁晶体(FeSO4·7H2O)(假设溶质和溶剂均无其他损失),要得到上述的硫酸亚铁晶体(FeSO4·7H2O),所用稀硫酸的溶质质量分数是多少?
连云港市2005年初中毕业、升学统一考试
化学试题参考答案
一、选择题(每小题只有一个选项符合题意。第1至4题每题1分,第5至22题每题2分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | B | D | A | B | B | D | C | A | D | C |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | D | B | A | C | A | C | D | A | C | A | A |
二、选择题(本题包括5小题, 共19分)
23.(4分)2N ,3Fe3+ ,2CH4 ,CuSO4·5H2O
24.(4分)⑴H2O ; ⑵ SO3 ; ⑶ NaOH ;⑷NaNO3
25.(3分)-1价,Na2CO3,白
26.(8分)⑴胃酸(或盐酸),![]() ⑵
⑵![]() ,
,![]()
⑶ ![]() ⑷A ,B
⑸答案合理即可给分
⑷A ,B
⑸答案合理即可给分
三、简答题(本题包括3小题, 共15分)
27.(6分)⑴二 ⑵HNO3 ,检验碳酸根离子;HNO3 ,除尽碳酸根离子;Ba(NO3)2
28.(3分)⑴![]() ⑵①Cl2>Br2>I2>S ,②B
⑵①Cl2>Br2>I2>S ,②B
29.(6分)第一组NaOH 、CaCO3;第二组NaOH 、Na2CO3、Ba(NO3)2;
第三组NaOH 、Na2CO3、Ba(NO3)2、CaCO3;
四、实验题(本题包括2小题, 共12分)
30.(3分)导管口有气泡冒出 ,进入集气瓶内的水约占其容积的1/5 ,澄清的石灰水不变浑
31.(9分)⑴①除去CO2 ②将导管从水槽中移出,熄灭酒精灯
⑵D
⑶①11a/(8b) , ②不正确;空气中的CO2会进入装置,使测定结果不准确;
盛有氢氧化钠溶液的洗气瓶(或装有碱石灰的干燥管);是
五、综合题(本题共7分)
32.(7分)⑴①C ②烧碱被反应掉;产生的次氯酸使红色褪去
⑵①氮、磷
② ![]() ;6.1
;6.1
六、计算题(本题共7分)
33.(7分)解⑴设16ml该酱油中含铁元素质量为x
由题意得:100ml∶(200mg ×12 .5%)=16ml∶x
解得:x= 4mg
∴此人一天从酱油中吸收的铁元素质量为4mg×10%=0.4 mg
⑵设需要硫酸亚铁晶体(FeSO4·7H2O)晶体质量为y
Fe ~ FeSO4·7H2O
56 278
1.12g y
56∶1.12 g =278∶y
解得y=5.56g
⑶设所用稀硫酸的溶质质量分数是z ,稀硫酸的质量为m,
则稀硫酸中硫酸质量为mz ,水的质量为m(1-z)
∴FeSO4·7H2O中结晶水的质量为m(1-z)
设生成的FeSO4质量为p
![]()
98 152
mz p
98∶mz=152∶p 解得p=152mz/98=76mz/49
∴(76mz/49) ∶[m(1—z)]=152∶126
解得z=43.8%
答:⑴0.4 mg; ⑵5.56g ⑶43.8%