威海市二OO六年初中升学考试化学试卷
注意事项:
1.本试题共7页,共70分.考试时间为60分钟.
2.答卷前,请将密封线内的项目填写清楚.
3.本试卷全部为笔答卷,用蓝、黑色钢笔或圆珠笔直接答在试卷上
相对原子质量:H一1 C一12 N一14 O一16 Na一23 Mg一24 S一32 Cl一35.5
| 第一题 答案栏 | 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 |
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项是正确的
将正确答案的字母代号填在上面的答案栏中。)
1、化学上称“原子是化学变化中的最小粒子”的根据是
A.原子的质量极小 B.原子是构成物质的最小粒子
c.原子的体积极小 D.原子在化学反应前后的种类、数目不变
2、威海某药业公司生产的药品——迪素,主要用于治疗敏感性细菌所致呼吸系统、泌尿系统感染。已知迪素的主要成分头孢克洛的化学式为C15H14ClN3O4S·H2O,下列关于头孢克洛的说法中,不正确的是
A.头孢克洛每个分子中含有41个原子
B.每个头孢克洛分子中含有一个水分子
C.头孢克洛是由C、H、C1、N、O、S六种元素组成
 D.头孢克洛分子的相对分子质量为385.5
D.头孢克洛分子的相对分子质量为385.5
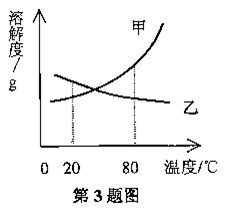
3.甲、乙两种固体物质的溶解度曲线如图所示。现有80℃时两者的饱和溶液各半烧杯,且烧杯中各含有少量甲和乙固体。现将温度从80℃降到20℃,下列说法正确的是
A.甲、.乙溶液中溶质质量分数都减少
B.甲、乙溶解度随温度降低而减小
C.烧杯中甲固体质量增加,乙固体质量减少
D.甲溶液质量变小,乙溶液质量变大,且一定都是饱和溶液
4.下列对一些事实的解释不正确的是
| 事实 | 解释 | |
| A、 | 乙醇可以制造饮料,而甲醇有毒 | 物质组成元素不同,分子结构也不同 |
| B、 | 0℃时水结成冰,而海水在 一1.9℃才会结冰 | 海水中溶解的盐电离出的离子,妨碍了冰晶体的形成 |
| C、 | 溶液之间的化学反应比固体之间的化学反应快 | 参加反应的粒子在溶液中接触的机会比在固体中接触的机会多 |
| D、 | KmnO4,溶液和K2SO4,溶液的颜色不同 | 两种溶液中的阴离子不同 |
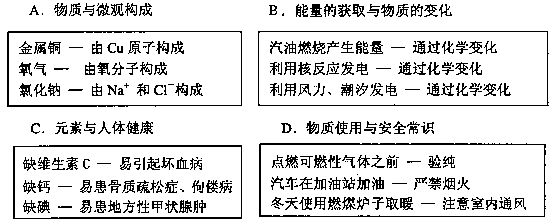
5.下面是小李同学用连线方式对某一主题知识进行归纳的情况,其中有错误的是
二、填空与简答题(本题包括5小题,共31分)
6.(5分)为了获得人类生活和发展需要的各种物质,并更好地利用这些物质,化学家们通常按照某种标准,将众多的化学物质进行分类。根据你学过的初中化学知识,按照物质的组成,将空气、硫酸铵、石墨、铜、氢气、纯碱、氧化镁、烧碱、乙醇、食盐水进行分类。(要求用框图的形式表示,层次分明,分类精细。
7.(8分)某化工厂用石灰石制取碳酸钙,流程图为
(1) 请写出上述方案中所依据反应的化学方程式
①
②
③
(2)请你仍然用石灰石为原料,其他试剂任选,设计另外一种制备碳酸钙的实验方案,将你的实验方案用流程图的形式表示出来:
![]()
 8.(8分)人类对原子结构的认识是逐渐深入的。右图是不同时期科学家提出的原子结构模型。
8.(8分)人类对原子结构的认识是逐渐深入的。右图是不同时期科学家提出的原子结构模型。
1808年,英国科学家道尔顿提出了原子论。他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割;同一类原子性质相同;不同的原子是以简单的整数比相结合。
1897年,英国科学家汤姆生发现原子中存在电子。1904年汤姆生提出了一个被称为
“西瓜式”结构的原子结构模型,电子就像“西瓜子”一样镶嵌在带正电的“西瓜瓤”中。
电子的发现使人们认识到原子是由更小的粒子构成的。
1911年英国科学家卢瑟福做了一个实验:用一束质量比电子大很多的带正电的高速运
动的。粒子轰击金箔,结果是大多数。粒子能穿过金箔且不改变原来的前进方向,但也有
一小部分改变了原来的方向,还有极少数的。粒子被反弹了回来。据此他提出了带核的原
子结构模型:原子是由原子核和核外电子构成。
……
根据以上材料,请回答:
(1)道尔顿提出了原子论,汤姆生发现了原子中的电子,这在当时是件很了不起的事,但由于受到那时科学技术水平的限制,他们的理论中存在一些缺陷甚至错误,按照目前初中阶段你学的原子结构的理论,你认为道尔顿的原子论存在的缺陷是
;
汤姆生原子结构模型的缺陷是
。
(2)根据卢瑟福的实验所产生的现象,不能够获得的结论是 。
A.原子核体积很小 B.原子核质量较大 C.原子核带有正电 D.核外电子带有负电
(3)通过人类认识原子结构的历史,你对科学的发展有哪些感想?
。
9.(6分)阅读下列材料:
材料1.2006年5月27日,央视《焦点访谈》栏日报道了“齐二药假药事件调查”。
由于“齐二药”管理混乱,购进了假药,化验员又错误地将 “二甘醇”当做“丙二醇”
使用,截止到5月22号,该厂生产的“亮菌甲素注射液”已造成9人死亡。
材料2.丙二醇与二甘醇比较:
| 丙二醇 | 二甘醇 | |
| 化学式 | C3H8O2 | C4H10O3 |
| 性质 | 无色、无臭味、有吸水性的粘稠状液体, 微甜,易燃,熔点27℃; 适量接触或服用对人体没有伤害 | 无色、有辛辣气味、有吸水性的油状液体,易燃,熔点-10.45℃; 化学性质与丙二醇相似,但有毒 |
| 市场价格 | 医药级:100000元/吨 | 6000元/吨 |
| 用途 | 化工原料和医药辅料,可作为溶剂、保湿剂使用,在美容品中常可看见。 | 化工原料,主要作为工业溶剂,防冻剂。 |
结合上述材料,回答下列问题:
(1)从元素组成和物质分类的角度看,丙二醇和二甘醇的相同点是
。
(2)根据材料2中的信息,作为一名检验员,你认为如何初步识别丙二醇和二甘醇?
。
(3)上面的事实说明,化学物质可以造福人类,但使用不当也会给人类带来危害。
针对齐二药假药事件,你认为采取哪些措施可以避免类似悲剧的再次发生?
。
10.(4分)下表是不同溶质质量分数的硫酸溶液和氨水与其相应密度的对照表
| 溶液中溶质的质量分数 | 4% | 2% | 16% | 24% | 28 |
| 硫酸溶液的密度(20℃)/g·ml | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度(20~C)/g·ml | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
请你仔细分析上表中的数据,回答下列问题:
(1)从上表可以看出,硫酸溶液的密度大于水的密度,而氨水的密度则小于水的密
度。除此以外,你还能够总结出溶液密度与其溶质的质量分数的变化规律是
。
(2)试从物质定量组成(氨水的溶质为NH3)的角度分析,为什么这两种溶液密度与其溶质的质量分数之间存在这种变化规律?
。
三、实验与探究(本题包括1小题,共18分)
11.(18分)实验与探究:追踪氧气和二氧化碳的足迹
据科学家估计,全世界生物的呼吸和燃烧所消耗的氧气,每秒钟可达l万吨左右。但
是我们生活中并没有明显感到环境中氧气不足,这是什么原因呢?
事实上,把地球作为一个整体,一些化学变化在消耗氧气的同时,另一些变化又在产
生氧气,并且维持一种动态平衡。科学研究发现,地球的再生氧气主要来源于地球臭氧层
电场电流对水分子的电解和绿色植物的光合作用。
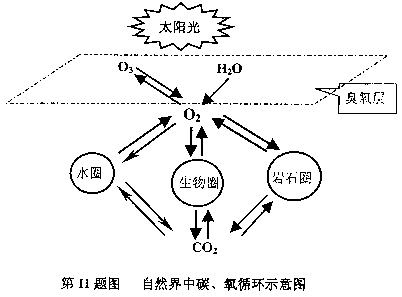 下图是自然界中碳、氧循环的主要途径:
下图是自然界中碳、氧循环的主要途径:
根据上图,运用你学过的有关知识,回答下列问题。
(1)试写出自然界中两种不同类型的消耗氧气的途径
①
②
(2)请你设计一个实验,模拟(1)中消耗氧气的一种变化。将实验方案写在下面。
(3)在实验中,为了获得少量氧气,可以根据物质的性质,选择含有 元素的物质,通过控制反应条件来实现。请你用化学方程式表示在实验室里产生氧气的一个变化
![]() (4)另外有一种实验室产生少量氧气的简易方法:用过氧化氢的水溶液做反应物,反应条件是常温和二氧化锰做催化剂,反应的化学方程式为
。
(4)另外有一种实验室产生少量氧气的简易方法:用过氧化氢的水溶液做反应物,反应条件是常温和二氧化锰做催化剂,反应的化学方程式为
。
若根据该反应制取氧气,则发生装置跟制取 气体的发生装置相同,需要的仪器有 。与实验室用氯酸钾制取氧气比较,该反应的优点是
。现用溶质质量分数为30%、密度为1.1g/ml的过氧化氢溶液制取氧气。实验中,发现二氧化锰与过氧化氢溶液混合后,装置中产生氧气的速度太快,你认为可能的原因有
。
(5)从图中可以看出,碳和氧的循环过程是紧密联系在一起的一种自然过程。事实上,地球上的碳只有0.9%参与循环,99.1%都固定在岩石圈中,然而,人类对能源和资源的过度开发利用,已经影响到自然界中碳、氧循环。
①在上面叙述中所说中碳、氧循环是指 的循环。
A.碳和氧的单质 B.氧气和二氧化碳 C.碳元素和氧元素
②根据自然界中碳、氧循环示意图,试分别写出一个自然界中产生和消耗二氧化碳气体的化学方程式。
产生二氧化碳的反应
消耗二氧化碳的反应 。
③为了遏制大气中二氧化碳不断增加的趋势,维护好自然界中碳、氧循环,请你提出两点措施 ;
。
四、计算(本题包括1小题,共6分)
12.(6分)镁是重要的金属材料,广泛应用于合金、火箭和飞机制造业,世界上大部分镁是从海水中提取的。威海是一座滨海城市,海岸线长达1000 km,海水资源丰富。某校学习小组的同学对家乡附近海水中镁元素的含量进行测定。称取海水100kg,然后再加入足量的氢氧化钠溶液,过滤、干燥、称量后得到沉淀质量见下表。(重复实验三次)。
| 第一次实验 | 第二次实验 | 第三次实验 | |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |
试计算海水中镁元素的质量分数。
(假定海水中镁元素全部以氯化镁的形式存在,不考虑沉淀中杂质的干扰)。
