《分子 原子》
一、分子
1、分子
(1)概念:分子是保持物质化学性质的最小粒子。
(2)有关概念的理解:
a.“保持”是指构成物质的每一个分子与该物质的化学性质相同。如氧分子保持氧气的化学性质,水分子保持水的化学性质。
同种物质的分子,化学性质相同。不同种物质的分子,化学性质不同,如从氧气O2,二氧化碳CO2的化学性质不同,可以证明氧气和二氧化碳的构成分子不同,二氧化碳中不存在氧分子。
b.“化学性质”:物质的性质分为物理性质和化学性质。分子只能保持物质的化学性质。而物理性质如状态,密度,熔点,沸点等,都是由该物质的大量分子聚集所表现的属性,是宏观的,并不是每一个单个分子所能表现出来的。如氧气的化学性质是构成氧气的每一个氧分子所表现出来的性质,而氧气的物理性质是由构成氧气的大量氧分子聚集而集合体现出来的性质,单个氧分子并不保持氧气的物理性质。
构成物质的分子聚集的方式不同,则物质的物理性质的宏观表象也不同。此时如果物质的分子没有发生变化,则分子保持的化学性质也不变。如在改变温度和压强的条件下,氧气的分子聚集方式发生变化,造成氧气的物理性质发生改变,如状态可以由气态变为液态或固态,颜色可以由无色变为淡蓝色等。但此时由于分子本身没有发生变化,所以化学性质保持不变。
c.“最小粒子”:由分子构成的物质在发生化学变化时,生成了其他物质,构成原物质的分子发生了改变,变成其他物质的分子。变化后的分子不能保持原物质的化学性质,故从保持原物质化学性质的角度,分子是保持物质化学性质的最小粒子。其他粒子,如“原子,离子”等将在以后章节中学习。在这里“最小粒子”应该理解为“其中最小粒子”。
注意:在由分子构成的物质中,分子是保持该物质化学性质的最小粒子。例如:氧分子是保持氧气化学性质的最小粒子。
2、分子的基本性质
(1)分子是构成物质的一种粒子,其质量、体积都非常小。
自然界中大多数的物质是由分子构成的。
(2)分子在不断地做高速的无规则运动。
温度越高,分子的能量越大,分子的运动速度就越快。
(3)分子之间有一定的间隔
通常情况下,如果分子间隔相对较大,物质就呈气态;如果分子的间隔相对较小,物质就呈液态或固态。
根据分子是不断运动的知识可解释物质的扩散(包括溶解,蒸发,挥发等)。根据分子之间有间隔可解释热胀冷缩现象和物质的气,液,固三态的变化。
3、用分子观点解释物理变化和化学变化
由分子构成的物质发生物理变化时,分子本身不发生变化。通常只是分子之间的间隔等发生了改变,所以在宏观表现上反映出来的仅仅是物质的物理性质等状态的改变,并没有其他物质的生成。例如:氧气在低温高压下,由无色气体变为淡蓝色液体或雪片状的固体时,氧分子本身没有发生变化,氧分子之间由气态时的大间隔变为液态或固态时的相对小间隔,为物理变化。
由分子构成的物质发生化学变化时,原来构成物质的分子自身首先被破坏,发生了改变,重新生成其他物质的分子,从宏观表现上反映出有其他物质生成。例如:我们做过的实验——给铜绿加热,受热时,碱式碳酸铜的分子被破坏,重新组合成氧化铜的分子,水分子和二氧化碳分子,分别生成了氧化铜,水和二氧化碳等其他物质,发生了化学变化。
注意:在化学变化中,分子的组成一定改变,分子的数目可能改变。
4、纯净物和混合物
| 混 合 物 | 纯 净 物 | |
| 区 别 | (1)宏观组成:由两种或两种以上物质组成 | (1)宏观组成:由同种物质组成 |
| (2)微观构成:由不同种物质的不同种粒子构成 | (2)微观构成:由同种物质的相同粒子构成 | |
| (3)有两种或两种以上的成分 | (3)成分单一 | |
| (4)一般无固定的组成,但有时有一定的组成范围 | (4)有固定的组成 | |
| (5)一般无固定的性质,如没有固定的熔点,沸点等 | (5)有一定的物理性质和化学性质 | |
| (6)各成分简单混合,相互间一般不反应 | (6)各组分通过一定比例发生化学变化后生成 | |
| (7)各成分保持自己原有的性质 | (7)各组分不再保持原有的性质 | |
| (8)一般不能用某一化学式来表示 | (8)能用一个化学式进行表示 | |
| 联 系 |
| |
| 例 | 海水,空气,稀有气体,石灰水等 | 氧气,水,二氧化碳,氯酸钾等 |
由分子构成的物质中,由同一种分子构成的是纯净物。如冰,水共存物实际为纯净物,因为其中的构成粒子只有一种——水分子,由不同种分子构成的是混合物,如红磷和白磷的混合体为混合物,区分纯净物和混合物的关键是把握“物质的种类”或“分子的种类”是否相同。
物质的纯与不纯只是相对而言的。自然界中绝对纯净的物质是不存在的。
二、原子
1、原子
(1)概念:原子是化学变化中的最小粒子。
(2)有关概念的理解:
a.“最小粒子”是在“化学变化”的前提下而言的。在化学变化过程中,原子不能再分,是最小粒子。但如果不考虑化学变化,原子还可以分为更小的粒子,如质子,中子,电子等。
b.在化学变化过程中原子是最小粒子是指原子的种类在化学变化中保持不变,即原子核中的质子和中子没有发生变化,但原子的核外电子数尤其是最外层电子数会发生变化。
2、原子的基本性质
(1)原子也是构成的物质的一种粒子,其质量,体积都非常小。
由原子直接构成的物质在初中阶段分为两种:金属和稀有气体。例如:铁、汞、氦气、氖气等就是由原子直接构成的。
注意:由分子构成的物质,其化学性质由分子保持,分子中的原子不保持物质的化学性质。例如水是由水分子构成的,水分子保持水的化学性质。水分子又是由氢原子和氧原子构成的。但其中的氢原子和氧原子既不保持氢气的性质,又不保持氧气的性质,更不保持水的性质。
如果是由原子直接构成的物质,则其化学性质由原子保持。例如在汞这种物质中,不存在汞分子,汞是由汞原子直接构成的,汞的化学性质由汞原子保持。
(2)原子同分子一样,也是时刻不停地做高速的无规则运动。
温度越高,能量越大,运动速度就越快。
(3)原子之间也有一定的间隔。
3、用原子-分子论解释化学变化的实质
从微观角度(即从原子、分子的观点)去分析,化学变化的实质实际上是一个“破而立”的过程,即构成物质的分子首先在一定条件下被破坏,分裂成原子,原子再重新组合生成其他物质的分子,这些新生成的分子再构成物质,有时,分裂成的原子也可直接构成物质。可以由下表加深理解:

从以上分析可以看出化学变化的实质就是在化学反应中,分子要分成原子,原子不能再分,原子要进行重新组合。
4、分子与原子的相同点
都是构成物质的一种粒子,质量和体积都非常小,彼此间有间隔,在不停地运动,都既有种类之分,又有个数之别,都不显电性。
5、分子与原子的不同
| 分 子 | 原 子 |
| (1)分子是保持物质化学性质的最小粒子 | (1)原子是化学变化中的最小粒子 |
| (2)在化学变化中分子的种类一定改变,数目可能改变 | (2)在化学变化中原子的种类,数目,质量均不改变 |
| (3)由分子构成的物质中化学性质由分子保持 | (3)由分子构成的物质中原子不保持物质的化学性质。由原子直接构成的物质中,原子才保持物质的化学性质 |
| (4)用化学式表示 | (4)用元素符号表示 |
| (5)分子由同种或不同种的原子构成 | (5)由质子、中子、核外电子构成 |
| (6)可以独立存在 | (6)多数情况下相互结合存在于分子中 |
| 分子与原子的联系:
| |
注意:分子与构成这种分子的原子相比较,原子比分子小,但并不是所有的原子都一定比分子小。如最小的氢分子中,一个分子共含有2个质子和2个电子,其体积和质量均没有氧原子大。一个氧原子中就含有8个质子,8个中子和8个电子。
6、原子的结构

注意:
(1)核电荷数=质子数=核外电子数 即原子核所带的电量与核外电子所带的电量相等,电性相反,所以整个原子不显电性。 (2)同一类原子,核电荷数即质子数相同。不同类原子,核电荷数即质子数不同。 (3)原子核内质子数不一定等于中子数。如铁原子中,质子数为26,中子数为30。 (4)并不是所有的原子中都存在中子。最常见的氢原子(普通氢原子)原子核内只有1个质子,却没有中子。 (5)因原子核外电子的质量很小,可忽略不计,所以原子的质量主要集中在原子核上,又因为原子核的体积很小,所以其密度特别大。 (6)原子核的性质:位于原子中心,体积极小,却几乎集中了原子全部的质量,每个原子只有一个原子核,原子核所带的正电荷数目简称为核电荷数。核电荷数决定了原子的种类。7、相对原子质量 (1)国际上是以一种碳原子(碳12,其原子核内有6个质子和6个中子)的质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,就是这种原子的相对原子质量。
(2)相对原子质量与原子实际质量的换算公式:
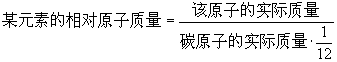
(3)相对原子质量是一个比值,国际单位制单位为1,一般不写出。 (4)相对原子质量越大,则该原子的实际质量也越大。 (5)近似相对原子质量=质子数+中子数
(6)作为相对原子质量标准的碳原子是一种有6个质子和6个中子的碳原子,也证明碳原子不止一种。例如还有质子数为6,中子数为8的碳原子,这些知识将在高中学习。
典型例题讲解
例1 下列物质中,前者属于纯净物,后者属于混合物的是( )
A.净化后的空气、氧化镁
B.水和冰混合、澄清石灰水
C.生锈的铁钉、高锰酸钾充分加热后的剩余固体
D.氯化钾、液氧
思路点拨:
本题将纯净物和混合物的概念组合考查,构造发散。
净化后的空气只除去了空气中的灰尘等杂质,仍属于混合物,(A)错;水和冰混合,因为只存在一种水分子,是纯净物,只是水和冰的状态不同,澄清石灰水是氢氧化钙[Ca(OH)2]溶液,属于混合物,(B)符合题意;生锈的铁钉是混合物,液氧是纯净物,(C)、(D)均不合题意。
解答:选B。
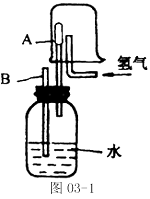
例2 已知在相同的温度下,气体分子的运动速度与分子的质量有关,相对分子质量越大,运动速度越慢。在图03-1中,容器A(器壁能允许气体分子通过)里充满了空气,当烧杯中充满氢气,并连续地通入氢气时,导管B处发生的现象是__________,产生这种现象的原因是____________。
思路点拨:
题中给出的信息“气体分子的运动速度与分子的质量有关,相对分子质量越大,运动速度越慢”。结合分子运动论知识,分子是在永不停息地做无规则运动,而A筒壁允许气体分子通过,氢气比空气的相对分子质量小,运动速度快,那么单位时间内进入A筒的氢气分子比逸出的空气分子多,使A中的气压大于外界大气压,因此,B管中有水喷出。
解答:有水喷出;进入A筒的氢气分子数比逸出的空气分子多,使A中的气压大于外界大气压,从而将广口瓶里的水从B管处压出,故看到B管有水喷出。
例3 对原子量的叙述:①原子量是以碳原子质量的1/12作为标准的;②原子量是以原子核内有6个质子和6个中子的那种碳原子质量的1/12作为标准的;③原子量就是以克作单位的一个原子的质量;④原子量只是一个比值,它是有单位的;⑤原子中决定原子量的微粒数是质子数和中子数。其中正确的是( )
A.①和③ B.②④和⑤ C.①③和⑤ D.②和④
思路点拨:
原子量不是原子的实际质量,它是有单位的;作为原子量标准的,是原子核内有6个质子和6个中子的那种碳原子(碳-12)质量的1/12,自然界中还存在另一种碳原子,它的原子核是由6个质子和7个中子构成的。这种碳-13原子不能用作原子量标准,叙述①笼统地说用碳原子质量的1/12作标准,显然是不正确的;原子的质量集中于原子核,所以,核内质子数和中子数是决定原子量的微粒。所以选项正确的有②、④、⑤。
解答:B
例4 在分子、原子、质子、中子、电子、原子核、离子这些微粒中:
(1)能直接构成物质的微粒有_________________;
(2)能保持物质化学性质的微粒有_____________;
(3)显示电中性的微粒有__________________;
(4)带正电的微粒有______________________;
(5)带负电的微粒有______________________;
(6)质量最小的微粒有_____________________;
(7)参加化学反应时,一定发生变化的微粒有__________;
(8)在同一原子里数目相等的是_____________;
(9)质量与氢原子质量近似相等的是____________。
思路点拨:
本题综合考查微观粒子的性质,思考容量大,解题的关键在于把各种微粒性质的异同点搞清楚。(1)能直接构成物质的微粒有分子(如氧气)、原子(如金属铜)和离子(如食盐NaCl);(2)能保持物质化学性质的微粒当然也包括分子、原子、离子、而分子只是保持物质化学性质的一种微粒;(3)分子、原子不显电性,而中子本身就不带电;(4)质子和原子核带正电荷,离子有阴离子和阳离子之分,其中阳离子带正电荷;(5)电子和阴离子带负电荷;(6)质量最小的微粒应为电子;(7)化学变化时分子一定要解离成原子,再重新结合成其他物质的分子;(8)原子之所以不带电,是因为带正电的质子与带负电的电子数目相等;(9)氢原子的相对质量为1,而中子和质子的相对质量也近似为1。
解答:(1)分子、原子、离子;(2)分子、原子、离子;(3)分子、原子、中子;
(4)原子核、质子、阳离子;(5)电子、阴离子;(6)电子 (7)分子 (8)质子和电子;(9)质子、中子;
例5 原子R核外有26个电子,核内有30个中子,它的质子数为_______相对原子质量约为______。
分析:
此题是根据原子的核电荷数=质子数=核外电子数,相对原子质量=质子数+中子数,这两个关系。已知R原子核外有26个电子,则核内应有26个质子。又因核内有30个中子,所以相对原子质量约为56。
答案:见分析。
例6 碳-12原子的质量为1.993×10-26kg,某原子的相对原子质量是80,则该原子的质量是______kg。
分析:
本题考查的是原子的质量和相对原子质量关系的计算。解题的关键是要搞清原子的质量和相对原于质量二者的区别和联系。
(l)相对原子质量不是原子的实际质量,而是一个比值。
![]()
它原子的质量跟它相比较所得的比值就是该种原子的相对原子质量。

某原子的相对原子质量为80,则该原子的质量为:1.66×10-27×80=1.328×10-25(kg)
答案:见分析。
学习时应注意的问题
CuSO4·5H2O是混合物吗?
有很多同学把CuSO4·5H2O当成混合物看待。造成这一错误的原因是认为硫酸铜晶体这一物质由无水硫酸铜和水这两种物质组成。CuSO4·5H2O是一种结晶水合物(严格说来应称“化学式”)。根据科学实验测定,每个硫酸铜分子跟五个水分子结合在一起,在条件不发生改变时,这一组成保持不变,分子中的H2O,不同于普通的H2O,是结晶水合物分子的一部分,所以CuSO4·5H2O是纯净物,且属化合物,不是混合物。
化学式中的“小圆点”(“·”)是表示一种结合,求算式量时应作加法,千万不要误作数学上的“乘号”。
(CuSO4·5H2O)的式量为:64+32+16×4+5(1×2+16)=250
课后答案
第一节 分 子
第1题 (1)化学。相同;各异。
(2)1.67×1023
第2题 (1)塞紧瓶塞可以防止酒精,汽油蒸气的分子因不断运动而扩散到空气中去,造成酒精、汽油的挥发而损失。
(2)气体分子之间有相对较大的间隔,气体受压时,迫使气体分子间距离缩小,因此其体积也相应缩小。
(3)太阳照射的地方,温度较高,湿衣服上附着的水分子能量增大,运动加剧(即增加了动能),更快地扩散到空气中去,所以容易干。
第3题 (1)、(2)不正确;(3)正确。
第4题 属于混合物的是:(2)、(7);属于纯净物的是:(1)、(3)、(4)、(5)、(6)。
第二节 原子
第1题 (1)B (2)B (3)B
第2题 构成原子的微粒有质子、中子和电子。在氧原子中由8个质子和8个中子构成原子核,有8个电子在核外一定空间内高速运动。质子带一个单位正电荷,中子不显电性,电子带一个单位负电荷。原子中核电荷数=质子数=核外电子数。由于整个原子中正负电荷数相等,所以不显电性。
第3题 (1)有错。原子量不是原子的实际质量。
原子量是国际上通用的,它以一种碳12原子质量的1/12作为标准,其它原子的质量跟它比较所得的数值。
(2)错。应改为:原子量的单位是一。
(3)对。
(4)对。
第4题 (1)水受热时其分子动能增大,分子间距离增大,由液态变成气态。
(2)氧化汞分子受热分解为汞原子和氧原子,每两个氧原子结合成氧气分子,汞原子则聚集成汞。
(3)蔗糖分子分散于水分子之间。
(4)樟脑分子从固体聚集状态升华为气态。
达标训练
一、选择题
1. 能闻到花香的原因是( )
A、分子有质量 B、分子间有间隔
C、分子在不断运动 D、分子体积小
2.对分子的叙述,正确的是( )
A、分子是构成物质的惟一粒子
B、由分子构成的物质,保持物质性质的是分子
C、同种物质的每一个分子化学性质都相同
D、分子的大小会随着物质的体积增大而变大
3.下列变化中,构成物质的分子本身发生变化的是( )
A、糖溶于水
B、衣箱中樟脑丸不久不见了
C、工业上蒸发液态空气制氧气
D、白磷自燃
4.在化学变化中必然会发生改变的是( )
A、分子的种类 B、原子的种类和数目
C、原子核内的质子数 D、原子的质量和性质
5、最早发现电子的科学家是( )
A.汤姆生 B.道尔顿 C.拉瓦锡 D.阿伏加德罗
6、分子和原子的主要区别是( )
A.分子是构成物质的微粒,原子不是构成物质的微粒
B.分子质量都大于原子质量
C.分子永恒运动,原子在分子中是不运动的
D.分子在化学反应中可分,原子在化学反应中不能再分
7、下列有关分子和原子的叙述中,错误的是( )
A.分子和原子都处于永恒的运动状态
B.分子和原子都是构成物质的微粒
C.分子和原子都是保持物质化学性质的最小微粒
D.分子和原子都可以再分
8、有分子参加的化学反应前后,一定发生改变的是( )
A.分子种类 B.原子种类 C.原子个数 D.原子量
9、下列叙述中正确的是( )
A.原子量就是原子质量
B.原子量的单位是千克或克
C.原子量是有单位的比值
D.没有原子量小于1的原子
10、下列关于物质的构成,叙述错误的是( )
A.氧酸钾分子由钾原子、氯原子、氧原子构成
B.氧分子由氧原子构成,氧原子由原子核和核外电子构成
C.氧原子核由带正电荷的中子和不带电荷的质子构成
D.水分子由氢原子和氧原子构成
二、填空题
 1.100毫升酒精和100毫升水混合后的液体体积小于200毫升,其原因是______。
1.100毫升酒精和100毫升水混合后的液体体积小于200毫升,其原因是______。
2.从分子观点看,由分子构成的物质,纯净物由____构成,混合物由____构成。
3.下列物质属于纯净物的是_____,属于混合物的是______。
①液态氧 ②汞 ③氧化汞 ④碘酒 ⑤石灰石 ⑥海水 ⑦硫硫铜 ⑧牛奶
4、分子是保持_________的一种微粒。分子之间有一定的_________。物质的三态,主要是由于___________发生变化的缘故。分子是在不断地___________。同种物质的分子性质__________,不同物质分子性质___________。一滴水里大约有_________个水分子。
5、V1毫升水与V2毫升酒精混合得V3毫升溶液,则V1+V2__________V3.(填“>”"=","<")。
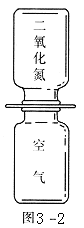
三、二氧化氮是大气污染物,是红棕色的、有毒的、密度比空气大的气体,如图3-2抽去中间的玻璃片,上下瓶口对准,过一会儿,可以看到什么现象?用分子观点解释这一现象。
拔高训练
一、选择题
1.下列物质中,肯定是由一种分子构成的物质是( )
A、水 B、纯净物 C、混合物 D、糖水
2.保持氯化氢化学性质的微粒是( )
A、氯化氢分子 B、氯原子
C、氢原子 D、氢原子和氯原子
3.下列事实或现象能说明“在化学反应中,分子可以再分而原子不能再分”的是( )
A、水受热时可以变成水蒸气
B、走进花圃时可以嗅到花的芳香
C、氧化汞受热分解生成汞和氧气
D、物体有热胀冷缩现象
4、已知一种碳12原子的质量为m克,另一种原子的质量为n克。则该原子的原子量为( )
![]()
5、已知某原子的原子核所带正电荷数为A,该原子核内有B个质子和C个中子,核外有D个电子了,则( )
A.A=B=C B.B=C=D C.A=C=D D.A=B=D
二、填空题
1.开采出来的石油(原油),没有固定的沸点。对原油加热,在不同温度下,分别有液体气化而出,经冷疑后被分离出来,这种操作叫分馏,用此法可分别得到各种馏分:溶剂油、汽油、航空煤油、柴油等。因此可判断,石油是____。(填纯净物或混合物)
2.一种碳(C-12)原子的质量是1.993×10-26千克,一个M原子的质量为9.288×10-26千克,则M原子量为:__________。
三、简答题
用分子观点解释下列现象:
水煮沸时,水蒸气会将壶盖顶开
参考答案
达标训练:
一、1.C 2.C 3.D 4.A 5、A 6、D 7、C 8、A 9、C 10、C
二、1. 酒精分子和水分子之间存在着间隔
2.同种分子,不同分子
3.①②③⑦ ④⑤⑥⑧
4、物质化学性质;间隔;分子间距离;运动;相同;不相同;1.67×1021。
5、V1+V2>V3。
三、上面的集气瓶中颜色逐渐加深,下面瓶中颜色逐渐变浅,这是因为二氧化氮分子和空气中气体分子都在运动,二氧化氮分子运动到上面的集气瓶中,空气中的氧分子、氮分子运动到下面集气瓶中,最后混合均匀,两瓶中颜色相同。
拔高训练:
一、1.A 2.A 3. C 4、B 5、D
二、1.混合物 2.56
三、水受热时,其分子的能量增大,分子间隔增大,水由液态变成气态,体积膨胀,将壶盖顶开