初二科学专题整理--水
一、水的组成与结构
水的组成与结构历来被视为常规性的考查点,可是2005年出现了图示题和电解水的开放题以及水组成的探究题,更体现了直观性和考查思维的深刻性。
1.(江苏常州8)下列关于水的说法不正确的是( )
A.水是生命活动不可缺少的物质
B.水是常见的溶剂
C.水既可作为反应物,也可以是生成物
D.水是由氢气和氧气组成的一种氧化物
2.(江苏南通5)下图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
 A.一个水分子由二个氢原子和一个氧原子构成
A.一个水分子由二个氢原子和一个氧原子构成
B.水分解后生成氢气和氧气的分子数比为2∶1
C.水分解过程中,分子的种类不变
D.水分解过程中,原子的数目不变
3.(广西桂林25)没有水,就没有生机勃勃的地球。小华与同学们为了探究水的组成,他们用如右图所示电解水的装置进行实验,通电后两电极都有气体放出,一段时间后,A试管中气体体积是B试管气体体积的两倍。经检验A试管里的气体能燃烧,B试管里的气体能使带火星的木条燃复。你认为上述实验现象可以说明的事实有:
(1)__________________________;
 (2)__________________________;
(2)__________________________;
(3)__________________________。
答案 (1)水在通电的情况条件被分解成H2和O2
(2)水是由氢元素和氧元素组成的
(3)在化学反应中分子可以再分
(4)电解水生成的H2和O2的体积比是2:1
(5)氢气可以燃烧
(6)氧气可以帮助燃烧
(7)……
4.(上海46)被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的双氧水(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体。在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
| 实验步骤 | 实验现象 | 实验结论 |
|
②分别向A、B两试管中 同时加入等质量(少量) 的二氧化锰,观察现象。 | A试管中无明显现象 B试管中有气泡产生 | A试管中的无色液体是:________; B试管中的无色液体是:________ |
(1)B试管中发生反应的化学方程式:________________
(2)如何验证B试管中产生的气体(写出操作步骤、实验现象和结论)?
________________________________________
答案 H2O;H2O2 (1)2H2O2![]() 2H2O+O2↑
2H2O+O2↑
(2)用带火星的木条放在试管口,复燃,证明是氧气。
二、水的性质与变化
水的性质主要指物理性质和化学性质。化学性质包括:水的稳定性、水的氧化性和与某些酸性或碱性氧化物的反应。水的变化有三态。水在工业、农业、生活、化学中有很大的用途。水的硬度是今年中考的一大亮点之一。
5.(河北12)下列关于水的说法中正确的是( )
A.水结成冰后体积变小
B.海水晒盐的原理是蒸发水得到晶体
C.水只要是无色透明的就能饮用
D.工业上用水降温是利用了水的比热容小的特性
6.(吉林课改16)使用硬水会给生活和生产带来许多麻烦。在日常生活中,我们最常用方法来降低水的硬度,这个过程主要是将水中的可溶性钙盐转化为碳酸钙(水垢的主要成分)沉淀的过程。如果想知道得到的水是软水还是硬水,我们可以用________检验。请你写出除水垢的化学方程式:________________________。
答案 煮沸 肥皂水 CaCO3+2HCl=CaCl2 + H2O +CO2↑(不配平或不写“↑”均扣1分,但不累积扣分,化学式写错不给分)
三、水的危机
爱护水资源的考查不再是“空洞的说教”,也不是单纯地考查节水徽记,而是更贴近学生的实际。通过考查,使学生树立节约用水,全球饮用水告急的观念。
7. (江苏徐州6)水是生命之源,保护水资源、节约用水是我们义不容辞的责任。下列做法不能节约用水的是( )
(江苏徐州6)水是生命之源,保护水资源、节约用水是我们义不容辞的责任。下列做法不能节约用水的是( )
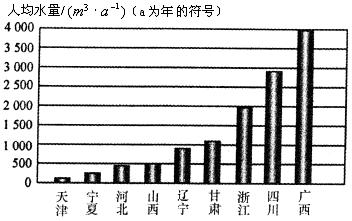
8.(天津20)今年天津市科技周的主题是“珍惜资源,建设节约型社会”。随着经济的发展,人口的增长和人民生活水平的提高,水资源短缺的问题日益突出。
下列资料是我国部分地区人均水量图和水资源紧缺指标表。
资料一:我国部分省市人均水量图
资料二:水资源紧缺指标表
| 紧缺性 | 极度缺水 | 重度缺水 | 中度缺水 | 轻度缺水 |
| 人均水量 |
|
|
|
|
请回答:
(1)根据资料一和资料二的数据,分析我市的水资源紧缺程度为________。
(2)节约用水是每一位市民应遵守的公德,而在日常生活中,我们经常会看到一些浪费水的现象,例如水龙头滴水、跑水的问题。如果一个水龙头按每秒钟滴2滴水,平均每20滴水为1毫升来计算,一昼夜将流失水的体积为________升。(计算结果保留一位小数)
答案 (1)极度缺水 (2)8.6
四、水的污染
水体污染主要来源于三个方面:①工农业生产中的废水、废物等未达标的排放;②农业上化肥、农药的不合理的使用;③生活污水的任意排放。2005年的中考在这三个方面又有新的突破,并结合了有关计算。
9.(北京海淀11)含氮、磷元素的大量污水任意排入湖泊、水库和近海海域,会出现水华、赤潮等水体污染问题。下列物质中,大量使用不会引发水华、赤潮的是( )
A.CO(NH2)2 B.Ca(H2PO4)2 C.Na2CO3 D.Na5P3O10
10.(北京12)北京市严重缺水,我们要保护好水资源。下列做法中,可能会造成水污染的是( )
A.生活污水经处理后排放 B.禁止含磷洗涤剂的使用
C.合理使用农药和化肥 D.在水库周边兴建造纸厂
11.(山东安丘30)生产、生活中的废物、污水未经处理就直接排放,是造成水体富营养化、河水被污染的重要原因。下图是长江中游某水质监测站在2004年8月的某天DO(溶解氧)的实测数据,下表为不同温度下DO(溶解氧)饱和值表:
| 水温/℃ | 25 | 26 | 27 | 29 | 31 | 32 | 34 |
| DO饱和值/mg·L-1 | 8.15 | 8.00 | 7.85 | 7.65 | 7.43 | 7.30 | 7.20 |
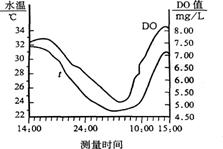 仔细观察实测数据和上表,回答问题:
仔细观察实测数据和上表,回答问题:
(1)在凌晨零点时,河水中的DO(溶解氧)仅为该温度下的DO饱和值的75%~80%;但在午后,DO出现过饱和,如在15时,DO饱和度可高达110%,造成上述现象的主要原因:
_____________________________________
_____________________________________
____________________________________。
(2)河水里的微生物使有机物(化学式以C6H10O5为代表)与溶解在水中的氧气作用而
转化为CO2和H2O的过程中所需的O2的量叫做BOD(生化需氧量),BOD是衡量水体质量的一个指标。当天该水质监测站测得河水中所含有机物的质量折合成C6H10O5为0.010 g·L-1,通过计算回答:
①该河段水体的BOD(生化需氧量)为______________ mg·L-1;
②该河段适合鱼类生存吗(设水温为25℃)?结论及理由是:______________
答案 (1)水温升高,DO饱和值下降:光照增强,水生植物光合作用加强,产氧量增加
(2)①11.85 mg·L-1
②不适合鱼类生存。因为25℃饱和DO值为8.15 mg·L-1,小于BOD的11.85 mg·L-1,会造成鱼类缺氧
五、水的净化
突出的新动向为:与重大水事件联系起来考查和全面了解自来水厂的净化水的原理以及利用新科技进行海水淡化。
12.(江苏泰州6)2004年12月26日印度洋发生海啸,灾民饮用水被严重污染,急需进行净化处理。下列净化水的单一操作中,净化程度最高的是( )
A.蒸馏 B.吸附沉淀 C.过滤 D.静置沉淀
13.(四川6)水是人类生活不可缺少的物质。日常生活中不少人喜欢喝纯净水,市售的纯净水有些就是蒸馏水。有关这类蒸馏水的下列说法正确的是( )
A.它可以通过冷却自来水受热产生的水蒸气而获得
B.它清洁、纯净,长期饮用对健康有益无害
C.它含有人体所需的矿物质和多种维生素
 D.它是纯天然饮品,不含任何化学物质
D.它是纯天然饮品,不含任何化学物质
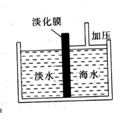
14.(福建厦门7)右图是采用膜分离技术的海水淡化装置。对海水加压后,只有水分子可以通过淡化膜,离子等其他粒子不能通过淡化膜。加压前后,装置右侧海水的( )增加。
A.溶质质量分数 B.溶剂质量
C.溶液质量 D.溶质质量
15.(湖北宜昌18)生活离不开水。净化水的知识在日常生活中有着广泛的应用。
(1)茶杯内的纱网,可将茶叶与茶水分离,便于饮用,该设计利用的化学原理是________。
(2)自制净水器中常加入________,用于除去水中的异味和色素。
(3)自来水厂用二氧化氯消毒杀菌,二氧化氯的化学式为________。
(4)井水中含有较多的钙、镁离子,为降低硬度,可采用的方法是________。
答案 (1)过滤 (2)活性炭 (3)ClO2 (4)加热煮沸(或蒸馏)
16.(江苏南通25)水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
(1)自来水的生产过程大体如下图:
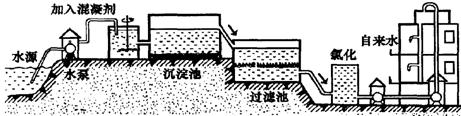
上图过滤池中有活性炭,活性炭起________作用,该过程发生的________变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配置AgNO3溶液时不宜用自来水,其原因是(用化学方程式表示)________________。高铁酸钾(K2FeO4)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是________。
(2)电解水时,加入少量的NaOH可以增强水的导电性。现将0.1gNaOH溶解在99.9g水里,接通直流电后,与电极正极相连的一端放出的气体是________,当溶液中NaOH的质量分数变为0.2%时,有________水被分解。
(3)如图,在河旁有甲、乙、丙、丁四座工厂,每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水中有红褐色物质生成;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是________。
②乙处河水有红褐色物质生成的化学方程式是
 ________________。
________________。
③丁处产生气泡的化学方程式是
________________。
(4)保护水资源,我们应该采取的措施是
________________。
答案 ⑴吸附 物理 AgNO3 + HCl = AgCl↓ + HNO3 +6
⑵O2 50.0 g 提示:电解水时,部分水分解后,水中NaOH的质量并没有改变。只是因为水的质量减少了,NaOH的质量分数才增加,变为0.2 % 。可设有 x水被分解。则有0.1 g /(0.1 g +99.9 g - x )×100%=0.2 % x=50.0 g
⑶酚酞或石蕊 3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
⑷工农业生产中减少甚至消除水体污染物的产生或农业生产中使用高效低毒的农药、化肥
17.(江苏连云港32)今年3月22日“世界水日”的主题是“与水共生”。水资源的保护和合理使用已受到人们的普遍关注,请回答以下相关问题:
(1)水厂生产自来水常用适量的氯气消毒,以杀死有害细菌,氯气是有刺激性气味的有毒气体,常温下能溶于水,溶解的氯气部分与水起反应,生成盐酸和次氯酸(HClO),次氯酸能杀死水里的病菌,也能使有机色素褪色。
①有些不法商贩用自来水冒充纯净水出售,为辨别真伪,可选用的试剂是___________。
A.酚酞试液 B.氯化钡溶液 C.硝酸银溶液 D.硫酸铜溶液
②某同学用滴管将饱和氯水加入到含有酚酞试液的烧碱溶液中,当滴到最后一滴时,红色突然褪去,红色褪去的原因有两种:一是____________________,二是_________________________。
(2)近几年我国不少水域多次发生“赤潮”、“水华”现象,这是水中的藻类生长繁殖过快导致的水质恶化现象。
①已知藻类含有C134H243O110N16P的物质,则工业和生活污水中导致藻类生长过快的营养元素是___________(填名称)
②河水的微生物使有机物(假设以C6H10O5表示)转化成二氧化碳和水的过程所需氧气的量叫生化需氧量(简称BOD),BOD是衡量水体质量的一个指标。写出C6H10O5和氧气反应的化学方程式_______________________________。
某水质量监测站测得某河水段水体的BOD为7.2mg/L,该河段所含有机物的质量折合成C6H10O5为______________mg/L
答案 (1)①C ②烧碱被反应掉;产生的次氯酸使红色褪去
(2)①氮、磷 ②C6H10O5+6O2==6CO2+5H2O;6.1
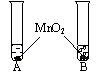 ①将等体积的两种无色液体分别加入A、B两个试管中。
①将等体积的两种无色液体分别加入A、B两个试管中。