九年级科学专题五酸碱盐及化肥
[知识网络]

[典例剖析]
例1、下列各组物质的溶液混合后,不一定会出现沉淀的是( )
A.Na2SO4、BaCl2、HNO3
B.KNO3、Na2CO3、CaCl2
C.MgSO4、NaOH、H2SO4
D.AgNO3、NaCl、HCl
解析:
A组中会产生不溶于稀HNO3的白色沉淀BaSO4,B组中会产生不溶性的CaCO3,C组H2SO4的量的多少会决定是否有沉淀产生,D组中会产生不溶于稀HNO3的白色沉淀AgCl。
答案:C
例2、下列物质长期暴露在空气中,溶质成分不变,但溶质质量分数减小且溶液质量增加的是( )
A.浓硫酸 B.浓盐酸 C.浓硝酸 D.氢氧化钠溶液
解析:
题中四选项所给的是几种常见的酸和碱,考查的目的是检查学生对这些重要化工原料性质的了解和掌握情况。解题的关键是对这几种酸、碱一些相关性质的认识,再将答题的三个要点与其联系进行分析:浓盐酸和浓硝酸具有挥发性,长期暴露在空气中,溶质挥发后,溶质质量分数减小、溶液质量也减小,但溶质成分不变;浓硫酸具有吸水性,长期暴露在空气中能吸收空气里的水分,溶质质量分数减小,溶液质量增大,但溶质成分不变;氢氧化钠则不同,它长期暴露在空气中能吸收二氧化碳并发生反应:2NaOH+CO2=Na2CO3+H2O,由此看出,它也不符合答题要点:NaOH ![]() Na2CO3,溶质成分变化了。
Na2CO3,溶质成分变化了。
答案:A
例3、“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变红后变紫
解析:
这是一道应用生活中的常识和化学知识,考查学生对酸碱指示剂变色范围的了解和对碳酸性质的认识的题目。解题的关键要对下列过程有所认识:CO2+H2O=H2CO3,使紫色石蕊试液变红;H2CO3![]() CO2↑+H2O,紫色石蕊试液由红到紫。
CO2↑+H2O,紫色石蕊试液由红到紫。
答案:D
例4、鱼胆弄破后会使鱼肉粘上难溶于水的胆汁酸(一种酸)而变苦,要减少这种苦味。用来洗涤的最佳物质是 ( )
A.水 B.纯碱 C.食盐 D.食醋
解析:
这是一个典型的用所学知识解决生活中常见问题的题目。解题的关键要知道纯碱是Na2CO3一种常见的盐,但它的水溶液呈碱性,可用于日常生活的某些方面。这样结合题意便可知道除去胆汁酸的最佳物质是纯碱。
答案:B
例5、在发酵面团中加入下列某种物质的溶液揉和,既能除去面团中的酸,又能使蒸出的馒头疏松多孔。这种物质是( )
A.Na2CO3 B.Ca(OH)2 C.CaO D.NaCl
解析:
常见的盐不仅与工农业生产有关,与人们日常生活也密切相关,该题就是一例。考查的目的是进一步使学生认识到生活中有科学、生活中有化学,并能用化学知识解释日常生活中的问题。解题的关键是理解下列过程:面团发酵——产生有机酸的化学反应过程;除去面团中的酸且不带来危害——Na2CO3溶液呈碱性,可除去酸味;蒸出的馒头疏松多孔——有机酸与Na2CO3反应产生的CO2受热体积膨胀,形成许多气孔。
答案:A
例6、在植物生长过程中,施用氮肥能使枝叶繁茂、磷肥能使果实饱满、钾肥能使茎秆健壮。种植吃叶的蔬菜(如青菜),应施用较多的化肥是( )
A.磷肥 B.NH4NO3 C.K2SO4 D.微量元素肥料
解析:
现代化农业离不开化肥,但化肥的任意施用会造成环境污染。该题考查的目的是让学生了解各种化肥不同的作用,学会合理施用化肥,认识到科学种田、科学栽培作物的重要性。解题只要了解常见的氮肥、磷肥、钾肥以及人们种植青菜需要那些种类的化肥即可。
答案:B
例7、下列各组物质中,不能发生反应的是( )
A.AgNO3溶液与NaCl溶液 B.BaCl2溶液与K2SO4溶液
C.FeCl3溶液与KOH溶液 D.KNO3溶液与Na2SO4溶液
解析:
此题考查了学生对复分解反应条件及其规律的理解情况和应用能力。解题的关键是真正理解和掌握复分解反应的条件和规律,这样才能应用这些知识解决上述题中问题。复分解反应主要是酸、碱、盐三类物质间的反应,但并不是任意间都能反应的,发生反应的条件有两方面:一、对生成物的要求,即有水或气体或沉淀产生,该反应便可能发生;二、对反应物是否呈溶液状态的要求,即有酸参加的反应,只要酸是溶液即可(指酸与碱或酸与盐的反应);无酸参加的反应,必须均是溶液才行(指碱与盐或盐与盐的反应)。将以上两方面条件结合起来应用到题中进行分析,便得出正确答案。
答案:D
例8、下列两组物质:(甲)CO2、H2、O2、Fe;(乙)AgNO3、CuSO4、Hg(NO3)2、HCl。
⑴甲组中的_________能与乙组中所有物质反应。
⑵甲乙两组物质中各有一种在物质分类上与其它三种不同,它们依次是________、_________。
解析:
该题考查了学生对各种物质性质的了解情况和对物质分类知识的认识。解题时只要对甲、乙两组物质的化学性质和物质类别有一个基本了解和认识,就不难作出解答。利用甲组中各物质的化学性质逐一代入到乙组各物质进行判断,只有Fe因它在金属活动性顺序里的位置决定了可以与乙组中四种物质发生反应。至于物质类别的判断,除了利用已有的分类结果进行选择外,还可以灵活的自行确定标准进行分类解题:甲组物质中与其它物质类别不同的是CO2(氧化物或化合物);乙组物质中与其它物质类别不同的是HCl(酸)。
答案:
⑴Fe
⑵CO2
HCl
[名题热身]
1、可用于清洗铁制品表面铁锈的是( )
A.水 B.氢氧化钠溶液 C.硫酸铜溶液 D.稀硫酸
2、食醋是醋酸的稀溶液,某同学准备在家中进行验证食醋具有酸的性质的实验,他选择了下列物质,其中能发生反应的是( )
A.木炭 B.纯碱 C.铁钉 D.食盐
3、在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是( )
A.CO2 B.CaO C.Cu(NO3)2 D.HCl
4、市场上有一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,罐内饮料温度就会降低,这种固体物质可能是( )
A.硝酸铵 B.烧碱 C.食盐 D.熟石灰
5、下表列出了四种农作物生长最适宜的pH范围:
| 农作物 | 棉 花 | 玉 米 | 大 豆 | 茶 树 |
| pH | 6.0---6.8 | 6.0—7.0 | 6.5—7.5 | 5.0—5.5 |
某同学测定得知,当地土壤的pH接近7。以上农作物最不适宜种植的是( )
A.棉花 B.玉米 C.大豆 D.茶树
6、某同学在化学晚会上为大家现场作了一幅《镜湖灯影》的景色画:他在白纸上用干净的毛笔蘸取甲溶液“画上”一串灯影,再用另一支毛笔蘸取乙溶液在灯影周围“画上”一片湖水,将白纸挂在墙上,待晾干后,用装有丙溶液的喷雾器向白纸上喷洒。结果出现了“蓝色的湖面上倒映着红色的灯影”的画面。该同学所用的甲、乙、丙三种溶液可能是右表四项中的( )
|
| 甲 | 乙 | 丙 |
| A | 稀盐酸 | 氢氧化钾溶液 | 石蕊试液 |
| B | 稀盐酸 | 氢氧化钠溶液 | 酚酞试液 |
| C | 氯化钠溶液 | 硫酸钾溶液 | 硫酸钠溶液 |
| D | 石灰水 | 稀硫酸 | 氯化钡溶液 |
7、“雪碧”等碳酸型饮料的pH小于7,晃动后打开瓶盖,其pH将( )
A.变大 B.变小 C.不变 D.无法判断
8、下面是某同学对有关火星探测资料的分析,其中结论错误的是( )
|
| 火星探测的有关资料 | 结 论 |
| A | 火星南、北两极的极冠温度常年在-70℃至-140℃之间 | 那里很难找到液态水 |
| B | 在火星南、北两极发现“干冰“ | “干冰“是固体二氧化碳 |
| C | 火星大气中存在甲烷气体 | 甲烷属于有机化合物 |
| D | 在火星上发现了大量盐的晶体 | 盐就是氯化钠 |
9、草木灰是农村广泛使用的一种农家钾肥,它的水溶液显碱性。下列化肥能与草木灰混合施用的是( )
A.CO(NH2)2 B.NH4Cl C.NH4NO3 D.(NH4)2SO4
10、严冬我国北方某些城市曾用食盐融雪,造成土壤中含盐浓度偏高,使路旁树木死亡。目前专家已研究出一种新型融雪剂,既能融化冰雪,又能起施肥养护树木的作用。具有上述作用的新型融雪剂是( )
A.氯化钠 氯化钙 B.氯化钠 氯化镁
C.氯化钠 醋酸钙镁 D.尿素 硝酸钙 硝酸镁
11、分别将下列各组物质,同时加到足量水中,能得到无色透明溶液的是( )
A.HNO3、KOH、FeCl3 B.K2SO4、KCl、HCl
C.AgNO3、HCl、KCl D.Na2CO3、KCl、BaCl2
12、在一定条件下,下列转化不能由一步反应实现的是( )
A.CO→CaCO3 B.HCl→NaCl
C.Fe→FeSO4 D.Ca(OH)2→NaOH
13、甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
A.甲一定是氢氧化钙溶液 B.乙一定是硝酸钾溶液
C.丙不可能是碳酸钠溶液 D.丁只能是盐酸
14、下列各组物质,不能按照关系图![]() (“→”表示反应一步完成)相互转化的是( )
(“→”表示反应一步完成)相互转化的是( )
|
| A | B | C | D |
| x | CaO | BaCl2 | Cu(NO3)2 | K2SO4 |
| y | CaCl2 | Ba(NO3)2 | Cu(OH)2 | KCl |
| z | CaCO3 | BaCO3 | CuSO4 | KNO3 |
15、食醋是常用的调味品,其主要成分是醋酸(化学式C2H4O2)。请回答:
⑴食醋显_____________(填“酸”或“碱”)性。
⑵若利用中和反应测定白醋中醋酸的质量分数,用酚酞作指示剂,滴加______________(填化学式)溶液至反应恰好完全,实验的现象是_______________________。
16、我们在初中化学里学过的一些物质,在实际生活中有重要的用途。现有以下物质:
A.不锈钢; B.氧气; C.生石灰(氧化钙); D.活性炭; E.二氧化碳;
F.水; G.醋酸; H.熟石灰(氢氧化钙); I.锌; J.盐酸。
请根据它们的用途,用字母代号填空(每种物质限选一次):
⑴_____________可供急救病人呼吸; ⑹_____________是最常用的溶剂;
⑵_____________可用于制造炊具; ⑺_____________可用来降低土壤的酸性;
⑶_____________可用作温室气体肥料; ⑻_____________可用于金属表面除锈;
⑷_____________可用作某些食品的干燥剂; ⑼_____________可用作干电池负极材料;
⑸_____________可用作冰箱的除臭剂; ⑽通常的食醋中含有约3%~5%的_____________。
17、我国古代纺织业常用氢氧化钾作漂洗剂。前人将贝壳(主要成分是碳酸钙)灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用,即可得氢氧化钾。
⑴上述过程中发生反应的基本类型共有_______种。
⑵发生复分解反应的化学方程式是:__________________________________________。
⑶如果要得到氢氧化钾溶液,还要经过_______________操作。
18、在一次化学探究活动中,晓琴同学无意中发现,两种无色溶液混合后,能产生一种白色沉淀。
⑴从无色溶液着手研究,若有一种是稀硫酸,则白色沉淀是_______________________,其化学方程式是_______________________________________。
⑵从白色沉淀着手研究,向其中加入稀硝酸,沉淀溶解,则白色沉淀的可能是_____________________,其化学方程式是 __________________________。
19、20世纪90年代我国的硫酸产量已达到1600万吨,标志着我国硫酸工业的飞速发展。工业生产硫酸的主要流程为:
①煅烧黄铁矿4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②SO2转化为SO3
③用浓H2SO4吸收SO3。
请回答相关问题:
⑴流程①中形成的炉渣如何进行再利用__________________________________。
⑵生产中会有部分SO2随尾气排入大气中,这会造成对环境的污染。SO2也是一种酸性氧化物,具有与CO2相似的化学性质,有人设计用消石灰吸收尾气中的SO2,请写出发生反应的化学方程式___________________________。
⑶SO3溶于水生成硫酸(H2SO4),它的酸性强于H2CO3,请设计一个简单实验证明这一结论(简要说出选用物质、实验方法及现象)______________________________________。
⑷若将一定量的SO2通入蔬菜大棚内,几天后大棚内的蔬菜将会__________________。
⑸工业生产得到的是浓硫酸,若要将它稀释成稀硫酸,则正确的操作方法是__________________________。
20、有三种可溶性正盐组成的固体混合物,其中两种是钠盐,按图所示步骤进行实验(假设能反应的均恰好完全反应)从以上实验判断:
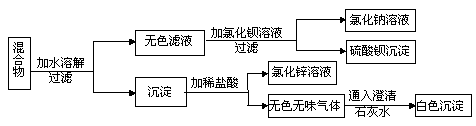
⑴原混合物中一定含有的物质是_____________;
⑵另外两种正盐可能是:_____________和_____________或_____________和_____________。
21、A、B、X、Y是初中化学常见的四种气体,它们之间有如图所示的转化关系。请写出:
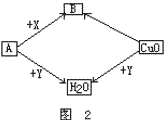
⑴Y、X的化学式:Y________________________,X_________________________。
⑵CuO→B的化学方程式:_____________________________________________。
22、某农民欲在一块土地上种植甜菜,他查阅资料得知甜菜是一种适合于在偏碱性土壤里生长的植物。
⑴请你设计实验帮助该农民测定其土壤的酸碱度。(写出主要操作步骤)
⑵若测得该土壤的pH约为5,你认为这块土地是否适合种植甜菜?为什么?若你认为水适合,应从下列物质中选择哪种物质对这块土地进行改良? 供选物质:①酸性肥料 ②熟石灰 ③氢氧化钠。
[参考答案]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| D | BC | B | A | D | A | A |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | A | D | B | A | B | D |
15、⑴酸
⑵NaOH(其他合理答案均可)溶液 由无色变为粉红色
16、⑴B ⑵A ⑶E ⑷C ⑸D ⑹F ⑺H ⑻J ⑼I ⑽G
17、⑴3
⑵Ca(OH)2 + K2CO3 =
CaCO3↓+ 2KOH
⑶过滤
18、⑴BaSO4;BaCl2+H2SO4 =
BaSO4↓+2HCl
⑵BaCO3;BaCO3+2HNO3
= Ba(NO3)2+H2O+CO2↑
19、⑴将炉渣用来炼铁。
⑵SO2+Ca(OH)2=CaSO3↓+H2O
⑶用pH试纸,分别测两溶液的pH,pH小的为硫酸,pH大的为碳酸。(或分别与碳酸钠反应,有气泡产生的是硫酸,无现象的是碳酸;或用紫色石蕊试液,根据颜色深浅区分)
⑷枯萎(或死亡)
⑸将浓硫酸沿着玻璃棒(或器壁)慢慢倒入水中,并用玻璃棒不断搅拌。
20、碳酸钠;氯化钠和硫酸锌或硫酸钠和硫酸锌或硫酸钠和氯化锌。
21、⑴H2,CO或CH4;
⑵CuO+CO![]() Cu+CO2
Cu+CO2
22、⑴取样;加水溶解;静置,取上方清液,用pH试纸测pH;确定酸碱度。
⑵不适合;土壤显酸性;②熟石灰。