高考化学复习模拟测试试题(十)
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案):
( D )1.拟晶(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。Al65Cu23Fe12是2000年之前发现的几百种拟晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是
A.Al65Cu23Fe12的硬度比金属Al、Cu、Fe都大
B.Al65Cu23Fe12中三种金属的化合价均可视作零
C.Al65Cu23Fe12不可用作长期浸泡在海水中的材料
D.1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
( A )2.下表中实验操作能达到实验目的的是
| 选 项 | 实 验 操 作 | 实 验 目 的 |
| A | 加新制的Cu(OH)2并加热 | 确定尿液中混有葡萄糖 |
| B | 滴加稀溴水 | 确定苯中混有苯酚 |
| C | 加入金属钠 | 确定酒精中混有醋酸 |
| D | 将石油裂解气通入酸性高锰酸钾 | 确定裂解气中含有乙烯 |
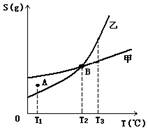 ( D )3.甲、乙两种物质的溶解度曲线如下图所示:
( D )3.甲、乙两种物质的溶解度曲线如下图所示:
下列说法一定正确的是
A. A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B. B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物质的量浓度相等
C. 将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的乙比析出的甲多
D. 若乙中含有少量的甲,可用重结晶的方法提纯乙
![]() ( C )4.盐酸乙哌立松片(Eperisone Hydrochloride
Tablets)是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧
( C )4.盐酸乙哌立松片(Eperisone Hydrochloride
Tablets)是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧
张状况,其结构简式如下:关于盐酸乙哌立松片有下列说法:
① 是芳香族化合物,② 含有N原子的六元环上所有原子均处于同一平面,③ 能发生还原反应的官能团有两种,④ 是一种有机盐。其中正确的是
A.①②③ B.②③④ C.①③④ D.①②④
( D )5. 下列推断符合实际的是
A. 第n周期的最后一种金属元素处在第n-l族
B. m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物
C. 第n周期有n种主族金属元素(1<n<7,n为正整数)
D. m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸
![]() ( D )6. 头孢拉定片(Cefradine Tablets),又称先锋,该药品适宜敏感菌所导致的急性咽炎,扁桃体炎,中耳炎等呼吸道感染。其结构式如图所示,有关该物质的描述正确的是
( D )6. 头孢拉定片(Cefradine Tablets),又称先锋,该药品适宜敏感菌所导致的急性咽炎,扁桃体炎,中耳炎等呼吸道感染。其结构式如图所示,有关该物质的描述正确的是
A. 分子式为C16H20N3O4S B. 该物质在一定条件下不能发生水解
C. 该有机物属于芳香族化合物 D. 该物质能与NaHCO3溶液反应放出CO2
( C)7. 全氟辛酸铵是在生产不粘锅涂层材料——特富龙(化学成分为聚四氟乙烯)的过程中使用的一种添加剂,可能对人体有害。据2005年6月27日美国环保署科学顾问委员会的一份调查报告,专家们通过在白老鼠身上做实验后发现,特富龙主要成分全氟辛酸铵在它们身上引发了一系列的肿瘤疾病。因此科学顾问委员会得出结论认为,不排除全氟辛酸铵对人体致癌的可能性。下列有关特富龙和全氟辛酸铵的说法正确的是
A. 前者属于有机高分子化合物,后者属于无机酸铵盐 B. 二者均属于无机物
C. 前者属于有机高分子化合物,后者属于有机酸铵盐 D. 二者均属于混合物
( C)8. 下列说法正确的是:①非金属氧化物一定不是碱性氧化物;②电解质溶液导电的过程属
于化学变化;③醛类既有还原性又有氧化性;④NaCl、SiO2、Al的熔点依次降低;⑤KNO3属于纯净物,又属于复合肥; ⑥稀有气体不活泼的原因是它们原子的最外层都达到8电子
稳定结构;⑦Fe(OH)3、FeCl2、SiH4都不能用直接化合法来制取
A. ①②④ B. ①②④⑥ C. ①②③⑤ D. 除④之外
( D )9. NA代表阿伏加德罗常数,下列说法正确的是
A. 9 g重水所含有的电子数为5NA
B. 1 mol MgCl2中含有的离子数为NA
C. 7.1 g 氯气与足量NaOH溶液反应,转移的电子数为0.2 NA
D. 1 mol C10H22分子中共价键总数为31NA
( C )10. 只能表示一个化学方程式的离子方程式为
A.Ba2++SO42-==BaSO4↓+2H2O B. CO32-+2H+==H2O+CO2↑
C. SO2+Cl2+2H2O==4H++2Cl-+SO42- D. 2Br-+Cl2==2Cl-+Br2
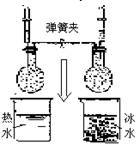 ( B )11.如右图,把NO2和N2O4的混合气体盛在两个联通的烧瓶里,调节左、右两边注射器内活塞,使其高度相等,关闭弹簧夹;同时把烧瓶一个放在热水里,另一个放在冰水里。下列对实验现象的描述错误的是
( B )11.如右图,把NO2和N2O4的混合气体盛在两个联通的烧瓶里,调节左、右两边注射器内活塞,使其高度相等,关闭弹簧夹;同时把烧瓶一个放在热水里,另一个放在冰水里。下列对实验现象的描述错误的是
A.左边注射器内的活塞高度比右边注射器内的活塞高度要高
B.左边注射器内的活塞与右边注射器内的活塞移动的方向和高度都相同
C.左边烧瓶内的颜色比右边烧瓶内的颜色深
D.两烧瓶内的化学平衡都发生了移动
( A )12. 在如图所示的三个容积相同的容器①②③中进行如下反应:
3A(g)+B(g)![]() 2C(g) ΔH<0 若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
2C(g) ΔH<0 若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为

A. ③②① B. ③①② C. ①②③ D. ②①③
( D )13.下列说法正确的是
A.不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
B.可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
C.在由水电离出的c ( H+ ) = 1×10-14 mol/L的溶液中可以大量存在Na+、K+、NO3-、HCO3-
D.实验室保存少量液溴和白磷常用水封
( C )14.某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为bmol。下列叙述,错误的是
A.溶液中c(H+) =[1000b+c(OH-)v]/v B.物质的量浓度c(HA) =1000a/Mvmol·L-1
C.t℃时,HA的溶解度S =100a/pvg D.HA的质量分数w(HA) =(a/pv)×100%
( C )15.X、Y、Z同属短周期元素。X元素的一种同位素是相对原子质量最小的一种核素,Y元素的最高正价与负价的代数和为2,Z元素原子的最外层实现8电子稳定结构所需电子数恰等于其K层电子数,则X、Y、Z三种元素所形成的化合物的化学式不可能是
A.XYZ2 B.XYZ3 C.X2YZ3 D.X3YZ4
二、实验题(每空3分,共27分)
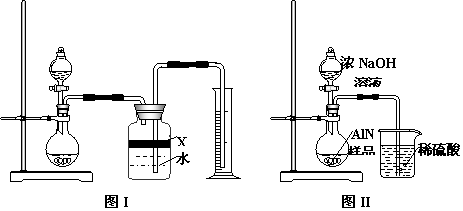
16.氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的
质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
⑴实验有关操作为:a、往烧瓶中放入适量的AlN样品:b、从分液漏斗往烧瓶中加入过
量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积。
正确的操作顺序为:c、a、b、d 。
⑵本试验中检查装置气密性的方法是:关闭分液漏斗活塞,微热圆底烧瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落 。
⑶广口瓶中的试剂X可选用AC 。(填选项的标号)
A.汽油 B.酒精 C.植物油 D.CCl4
⑷广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将不变 。(填偏大、偏小或不变)
⑸实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是 碳 。
⑹若实验中测得样品的质量为w g,氨气的体积为a L(标况下),则样品中AlN的质量分数为: 4100a/22.4w% 。
⑺有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为是否可行?不可行 。(填入“可行”、“不可行”)。原因是氨气极易被吸收,发生倒吸现象 ;改进的方法为烧杯导管的末端接一倒扣的漏斗来吸收氨气(或其它合理答案)。
三、推断题(本题共2小题,每空3分,共36分):
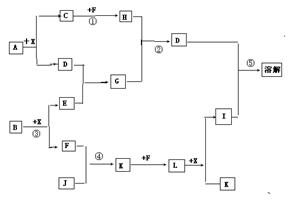
17. 已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75℅,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的氢化物,X为无色液体。反应生成的水均已略去。它们有如右的关系:
⑴写出化学式:
A:AlC B:NaO J:NH
⑵反应③中每生成1molF,转移电子的数目为 2mol ;
⑶反应④的化学方程式为:
4NH+5O====4NO+6HO
⑷写出②离子方程式
2AlO-+CO+3HO=2Al(OH)↓+CO
18. 四种短周期元素A、B、C、D,它们原子的电子层数与最外层电子数之比分别为:
1:(1/3), 1:1 , 1:2 和 1:3 。
据此回答下列问题:
⑴仅根据上述信息就能够确定的元素是 A、D (选填A、B、C、D)。
⑵在所有满足上述信息的短周期元素中,最高价氧化物的水化物酸性最强的是(填化学式)HSO ;由A、D两元素构成的化合物A2D2的电子式为(用元素符号填写,下同):
Na+[:O:O:]2-Na+。
⑶写出所有的满足上述信息的化合物CD2与化合物A2D2反应的化学方程式:
_ 2NaO+2CO==2NaCO+O↑; SO+NaO==NaSO 。
⑷在满足上述信息的短周期元素中,若B2、CD和由B、C、D形成的化合物X的混合物 mg,
在一定条件下与过量氧气充分反应后,将产物通过足量的固体A2D2,最终发现固体质量增重mg,则符合此条件的X的分子组成可用通式(CO)x·( H )y 来表示。
四、综合题:
18.含羟基的化合物可表示为M—OH(M是原子或原子团),当它与H+结合后可形成MOH2+离子,M—OH2+在一定条件下易失去H+或H2O分子。请回答:
⑴符合M—OH+2通式最简单的离子的电子式_H:O:H]+_ 。
⑵粒子中原子数、电子数都相等的粒子称等电子体,等电子体有相似的几何形状,上面⑴题中离子的几何形状为三角锥形 。
⑶同温同压下由A.CH3CH2OH2+;B.NH4+;C.HCO3-三者分别形成的水溶液,酸性由强到弱的次序为A>B>C _。
⑷液态乙醇中存在CH3CH2OH2+。能与该粒子反应且产物只有乙醇的粒子的化学式为:
CHCHO- 。
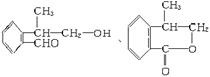
19. A为芳香烃的衍生物,只含C、H、O三种元素,苯环上只有两个取代基,并且这两个取代基处于邻位,A的相对分子质量为164,分子中只含两种官能团。A不能使FeCl3溶液显色,但可被银氨溶液氧化成B,B能在浓H2SO4存在和加热条件下发生分子内的酯化反应生成C,C分子中除苯环外还有一个含氧的六元环。请回答下列问题:
⑴B分子中的含氧官能团是羟基 、 羧基 (填名称)。
⑵A的苯环上两个取代基中的碳原子总数是:4 ___ 。
⑶符合上述条件的A有_4__ 种。
⑷试写出其中的任意一种A及其对应的C的结构简式___________________。
20.下列实验操作或实验所得出的结论一定正确的是: A、C、F、G
A.称量一定质量NaOH固体配制溶液时,应将NaOH放在小烧杯中称量;
B.某无色溶液加入盐酸产生无色无味气体,则溶液中一定含CO32-离子
C.可用酸式滴定管量取20.00mL高锰酸钾溶液
D.电解某无色液体得到H2和O2,测其体积比为2:1,则此液体为纯净水
E、配制一定浓度的NaCl溶液时,定容摇匀后,发现液面低于刻度线,要再加水到刻度线
F.用结晶法可以除去硝酸钾中混有的少量氯化钠
G.用渗析法分离淀粉中混有的NaCl杂质
H.SO2、乙烯、乙炔通入溴水都能被氧化而使溴水褪色
21.在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图所示:
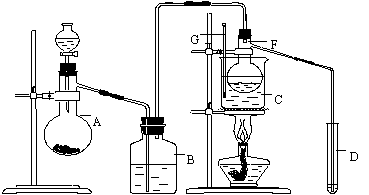 请回答以下问题:
请回答以下问题:
⑴实验开始时,仪器A中盛放电石,
B中应装入 NaOH溶液 ,其作用是:
除去由A装置导出的气流中混有的
HS杂质,避免在后续实验中所使
用的催化剂HgSO中毒 。
⑵仪器D中盛放水,其作用是:
吸收生成的乙醛蒸气 。
⑶蒸馏烧瓶F中应加入HgO和另外
两种试剂,若将三者分别直接加入,
请按加入的先后顺序写出包括HgO
在内的各试剂的名称: 氧化汞、水、浓硫酸 ,将HgO加入F中的操作方法是 将蒸馏烧瓶横置,用药匙或纸槽将HgO送入烧瓶底部,再慢慢竖立 。
⑷装置图中,加热F的方式叫 水浴加热 ,所选用温度计的量程表示正确的是 B (填代号)。
A.00C~500C B.00C~1000C C.00C~2000C D.500C~1000C E.00C~3600C
⑸检验乙醛已制出的操作、现象是取D中溶液少量,加新制Cu(OH)悬浊液,加热至沸腾,若产生砖红色沉淀则CHCHO已生成 。
高考化学模拟题(十)(答案)
一、选择题:
1.D 2.A 3.D 4.C 5.D 6.D 7.C 8.C 9.D 10.C 11.B 12.A 13.D 14.C 15.C
二、实验题:
16.⑴c、a、b、d 。 ⑵关闭分液漏斗活塞,微热圆底烧瓶,广口瓶中右侧导管
水柱上升,恒温时水柱并不回落 。
⑶AC 。 ⑷不变 。⑸ 碳 。 ⑹ 4100a/22.4w% 。
⑺不可行 。 氨气极易被吸收,发生倒吸现象 ; 烧杯导管的末端接一倒扣的漏斗来吸收氨气(或其它合理答案)。
三、推断题:
17. ⑴A:Al4C3 B:Na2O2 J:NH3
⑵ 2mol ;
⑶4NH3+5O2====4NO+6H2O
⑷2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
18.⑴ A、D 。 ⑵H2SO4 ; Na+[:O:O:]2-Na+。
⑶2Na2O2+2CO2==2Na2CO3+O↑; SO2+Na2O2==Na2SO4 。
⑷(CO)x·( H )y [或(H)x·(CO)y]
![]()
|
![]() 18. ⑴_[H:O:H]+_。
18. ⑴_[H:O:H]+_。
⑵三角锥形 。 ⑶A>B>C _。 ⑷CH3CH2O- 。
19. ⑴羟基 、 羧基 )。
⑵4 ___。⑶__4___。
⑷
20.A、C、F、G
21.⑴ NaOH溶液 , 除去由A装置导出的气流中混有的H2S杂质,避免在后续实验中所使用的催化剂HgSO4中毒 。
⑵ 吸收生成的乙醛蒸气 。
⑶ 氧化汞、水、浓硫酸 ,
将蒸馏烧瓶横置,用药匙或纸槽将HgO送入烧瓶底部,再慢慢竖立 。
⑷ B (填代号)。
⑸取D中溶液少量,加新制Cu(OH)2悬浊液,加热至沸腾,若产生砖红色沉淀则CH3CHO已生成 。