高考化学实验专题练习
1.⑴在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是 (填编号)。
①分馏石油时用的温度计 ②制备乙烯时用的温度计
③用水吸收溴化氢的导管口 ④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
 ⑵中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有 ______ (填写编号)。
⑵中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有 ______ (填写编号)。
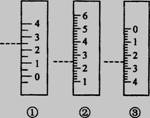
⑶右图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL
D.②是温度计,读数是2.5℃
2. 下列有关化学实验的操作或说法中,正确的是(填字母代号) 。
A.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合
物变稠,即可得到肥皂
B.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
C.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可
D.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得硫酸亚铁晶体
E.进行纤维素水解实验时,把一小团蓬松脱脂棉放入试管,滴入少量浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu(OH)2加热至沸腾即可
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G.用50mL量筒量取3.80mL盐酸 H.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
3⑴ 下列实验操作或对实验事实的描述不正确的是 (填序号)
① 已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
4.⑴下列仪器中,根据物质的沸点不同分离物质时需要的是 (填编号)。
①容量瓶 ②普通漏斗 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管
 ⑦燃烧匙 ⑧温度计 ⑨干燥管
⑦燃烧匙 ⑧温度计 ⑨干燥管
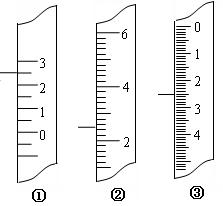
⑵ 右图分别是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是 。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
![]()
![]()
![]()
![]()
![]() C.③是滴定管,读数为3.5mL
C.③是滴定管,读数为3.5mL
D.①是温度计,读数为2.5℃
⑶ 实验室里不同化学试剂的保存方法不尽相同。下图中A、B、C、D、E是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内(多选倒扣分):
①NaOH溶液 ②浓硫酸 ③Na2CO3溶液 ④白磷 ⑤大理石 ⑥酒精 ⑦氯水 ⑧浓硝酸
| A | B | C | D | E |
|
| |
|
|
|
| ( ) | ( ) | ( ) | ( ) | ( ) |
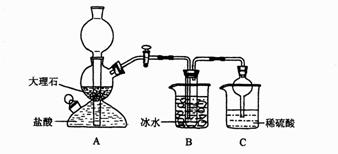
5、某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl.3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
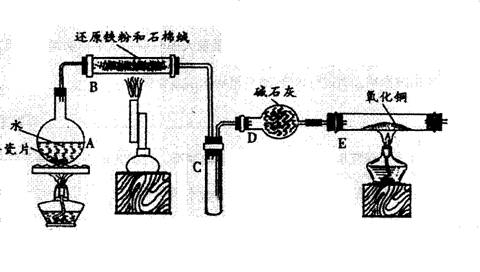 (1)装置B中发生反应的化学方程式是_________________________ ______;
(1)装置B中发生反应的化学方程式是_________________________ ______;
(2)反应前向A中放入碎瓷片的目的是_______________________________,装置A、B、E、三处均需要加热,A、B、E三处加热的先后顺序是(用A、B、E表示) ;
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。向滤液中加入KSCN溶液,溶液不显红色,说明滤液中不含有![]() 离子,你认为滤液中不含有
离子,你认为滤液中不含有![]() 离子可能的原因是:__________________________________________。
离子可能的原因是:__________________________________________。
(4)该小组利用(3)中滤液制取FeCl3•6H2O晶体设计流程如下:
![]()
①步骤I若向100mL滤液中通入224mL Cl2(标准状况下)恰好完全反应,则原滤液中金属离子浓度约为__________mol/L。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_______________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合必要的离子方程式简要说明)
________________________________________________________________________
_______________________________________________________________________。
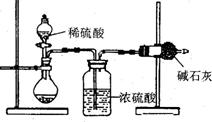 6、一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
6、一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
I.甲同学的方案如右图所示:
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行 次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分
数的数据存在较大的偏差,你认为原因可能是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
II.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,
称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)洗涤沉淀的操作要点是 。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是 ;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是 。
7、已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是 __;
(2)若推测该粉末只由Na2SO4组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
| 实验步骤 | 实验现象 | 反应离子方程式和结论 |
| ④ |
注:实验步骤的序号由你按顺序编号。实验现象、离子方程式和结论要与相应的实验步骤一一对应。
8、某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
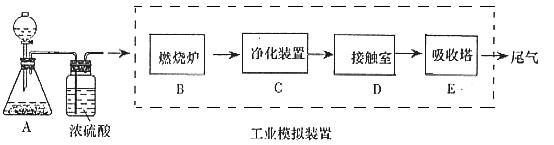
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为![]() ,在该反应中____________做氧化剂,若消耗了
,在该反应中____________做氧化剂,若消耗了![]() 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_____________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成![]() ,可放出
,可放出![]() 的热量,请写出该反应的热化学方程式__________________________________________;
的热量,请写出该反应的热化学方程式__________________________________________;
并回答在工业中不采取加压措施的原因________________________________________
__________________________________________________________________________;
(5)为检验从接触室出来的气体成分,甲同学设计如下实验:
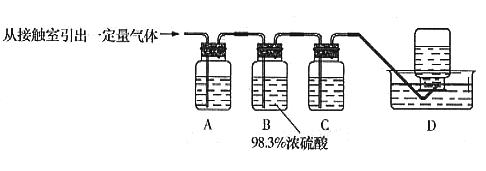
①A中盛放的试剂是____________________;
②B中盛放98.3%浓硫酸的作用是__________________________________________,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案________(填“可行”或“不可行”)说明理由_________________________________________________
___________________________________________________________________________;
③C中盛放的试剂是___________________________,其作用是__________________。
9、在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、
氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O NH4Cl+NaHCO3(晶体)依据此原理,欲制得碳酸钠晶体,某校
学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯
|
达到饱和:
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
|
溶 解 盐 度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水是因为 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得
到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的
试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,
而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论:
。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到
干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
10.摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原
剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
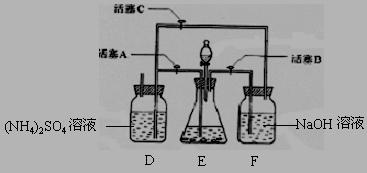
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
高三化学二轮复习专题(化学实验)答案
1.⑴ ②④⑤⑥ ⑵①②③ ⑶B
2.BCFH(4分)
3、⑴ 1257
4.⑴ ③⑧ (2分) ⑵ BD(2分) ⑶ ⑤、④、①③、②⑥、⑦⑧(5分)
5(1)3Fe+4H2O(g)
![]() Fe3O4+4H2 (3分)
Fe3O4+4H2 (3分)
(2)防止暴沸(1分) BAE (3分)
(3)溶液中的Fe3+离子被(未与水反应的)铁粉还原成Fe2- (2分)
(4)①0.2mol/L(2分) ②加热浓缩,冷却结晶,过滤。(2分)
![]() ③Fe3++3H2O Fe(OH)3+3H+(2分),过量盐酸抑制FeCl3水解(1分)
③Fe3++3H2O Fe(OH)3+3H+(2分),过量盐酸抑制FeCl3水解(1分)
6、Ⅰ(1)4 (2).ABCD Ⅱ (1).106n/197m (2)沿玻璃棒向过滤器中的沉淀加水至淹没沉淀,静置使其全部滤出,重复2~3次 (3)生成微溶的氢氧化钙;碳酸钡相对分子质量比碳酸钙大,故生成的碳酸钡质量多,测定的相对误差小
7.(1)只有![]() (1分);只有
(1分);只有![]() (1分);由
(1分);由![]() 和
和![]() 组成(1分);
组成(1分);
(2)
| 实验步骤 | 实验现象 | 反应离子方程式和结论 |
| ④取①中溶液少量,(1分) 滴加硝酸酸化的
⑤取①中溶液少量, 滴加硝酸酸化的
再加入硝酸酸化 的 | 产生白色沉淀(2分) 无明显现象(2分) |
说明 说明溶液中无 所以该粉末组成只有 (1分) |
8(1)![]() (2分)
(2分)
(2)氧气 (2分) ![]() (1分)
(1分)
(3)催化剂中毒 (1分)
(4)![]()
![]()
![]() ;
;![]() (2分)
(2分)
在常压下400℃~500℃时,![]() 的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。(2分)
的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。(2分)
(5)①氯化钡溶液 (2分) ②除去SO3,排除SO3对SO2检验的干扰 (2分)
不可行 虽然饱和![]() 溶液可除去
溶液可除去![]() ,但SO3与
,但SO3与![]() 反应生成SO2,干扰对原混合气体中SO2的检验。(2分)
反应生成SO2,干扰对原混合气体中SO2的检验。(2分)
③品红溶液(或溴水) 检验![]() (2分)
(2分)
9.(1)(2分)CaCO3+2H+ Ca2++CO2+H2O;(2分)吸收从B装置中的试管内逸出
的氨气,减少对环境的污染 (2)(2分)温度越低,碳酸氢钠的溶解度越小,便于析出(3)
(1分)A与B(1分)饱和NaHCO3溶液(其他合理答案均可给分)(2分)除去CO2中混
合的HCl气体 (4)(5分)取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还
有白色固体剩余,则晶体不是NH4HCO3;待试管冷却后,向剩余固体中加入适量盐酸,若
反应并产生大量气泡,则晶体是NaHCO3,而不是食盐。(其他合理答案均可给分)(5)(2
分)60%
10(1)除去混在氢气中的酸性气体(2分)
(2)A B、C (各1分,共2分) 将E中的产生的硫酸亚铁溶液压入D中(2分)
(3)②(2分)
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案(每空2分,共4分)

 温度
温度