高考化学实验预测题
1.某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
| (1) 草酸晶体 | 分子式 | H2C2O4·2H2O | 颜色 | 无色晶体 |
| 熔点 | 100.1℃ | 受热至100.1℃时失去结晶水,成为无水草酸。 | ||
| (2) 无水草酸 | 结构简式 | HOOC—COOH | 溶解性 | 能溶于水或乙醇 |
| 特性 | 大约在157℃升华(175℃以上发生分解)。 | |||
| 化学性质 | H2C2O4 + Ba(OH)2 =BaC2O4↓+ 2H2O | |||
| HOOC—COOH >175℃ CO2↑+CO↑+H2O↑ | ||||
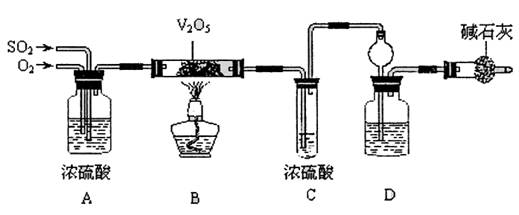
 该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接 h 。
(2)该组同学进行了下列实验操作:
① 点燃B处的酒精灯;
② 检查实验装置的气密性并装入药品;
③ 反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;
④ 点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤ 点燃尖嘴i处的酒精灯。
正确的实验操作顺序是: 。
(3)收集气体验纯的目的是 。
D装置中澄清石灰水的作用是 。
E装置中澄清石灰水的作用是 。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00 g,样品FexOy的质量为7.84 g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y= 。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。
2.(15分)下图中,甲由C、H、O三种元素组成,元素的质量比为12:3:8,甲的沸点为78.5℃,
其蒸气与H2的相对密度是23。将温度控制在400℃以下,按要求完成实验。
|
(1)在通入空气的条件下进行实验Ⅰ。
①甲的名称是 ,加入药品后的操作依次是 。
a.打开活塞 b.用鼓气气球不断鼓入空气 c.点燃酒精灯给铜丝加热
②实验结束,取试管中的溶液与新制的Cu(OH)2混合,加热至沸腾,实验现象为
。
③现用10%的NaOH溶液和2%的CuSO4溶液,制取本实验所用试剂Cu(OH)2,请简述实验操作。
。
(2)在停止通入空气的条件下进行实验Ⅱ。
①关闭活塞,为使甲持续进入反应管中,需要进行的操作是
。
②甲蒸气进入反应管后,在铜做催化剂有250~350℃条件下发生可逆的化学反应,
在试管中收集到了实验Ⅰ相同的产物,并有可燃性气体单质放出。该反应揭示了甲
催化氧化的本质。写出实验Ⅱ中反应的化学方程式,并结合该化学方程式简要说明实验Ⅰ中所通空气的作用。
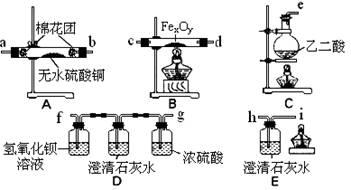
3.(16分)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质
m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
|
请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
。
(2)检查完装置的气密性且加入药品后,开始进行实验,此时首先应进行的操作是
。
(3)实验时A中氧气导冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是
;装置C中浓硫酸的作用为 ;
装置D中盛放的溶液中足量的 (选填字母)。
a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(5)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为wg。若装置D增加的质量为ag,则此条件下二氧化硫的转化率是
(用含字母的代数表示,结果可不化简)。
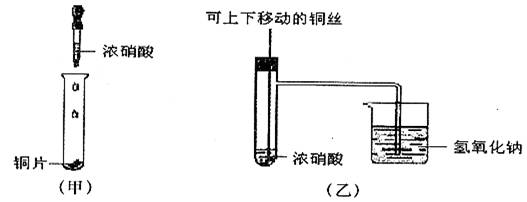
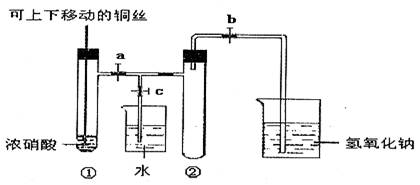
4.下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(丙)
(1)写出铜和浓硝酸反应的化学方程式______________________________________。
(2)和甲装置相比,乙装置的优点_____________________________________________
____________________________________________________________________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹_______,再打开弹簧夹______________,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作______________________________________________________________________
____________________________________________________________________________。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是_________________________(气体按标准状况计算)。
5.某校化学课外活动小组利用下面所提供的仪器装置和药品制取![]() 溶液,设计如下实验。实验室提供的药品、仪器装置如下:
溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀![]() ④饱和
④饱和![]() 溶液 ⑤浓
溶液 ⑤浓![]() ⑥
⑥![]() 固体 ⑦
固体 ⑦![]() 粉末仪器装置(如图13所示):
粉末仪器装置(如图13所示):
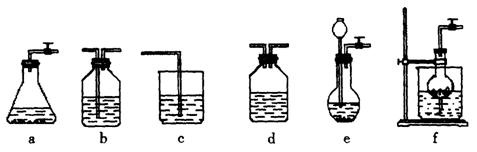
图13
请根据题目要求回答下列问题:
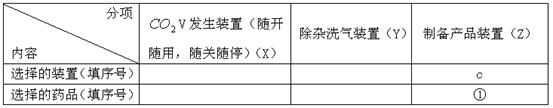
(1)请按下表要求,填写选择的装置和药品。
(2)如何检验所选择的![]() 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:
_____________________________________________________________________________
_____________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量![]() 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量![]() 后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
附:有关物质在常温(20℃)时的溶解度
| 化学式 |
|
| NaOH | NaCl |
|
| 溶解度(g/100g | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
6.Ⅰ.(8分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
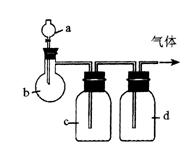
| 气体 | a | b | c | d |
| C2H4 | 乙醇 | 浓H2SO4 | NaOH溶液 | 浓H2SO4 |
| Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓H2SO4 |
| NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
| NO | 稀HNO3 | 铜屑 | H2O | P2O5 |
⑴上述方法中可以得到干燥、纯净的气体是 。
⑵指出不能用上述方法制取的气体,并说明理由(可以不填满)
① 气体_____________,理由是_________________________________________ 。
② 气体_____________,理由是_________________________________________ 。
③ 气体_____________,理由是_________________________________________ 。
④ 气体_____________,理由是_________________________________________ 。
Ⅱ.(8分)用下图装置进行实验,将A逐滴加入B 中。
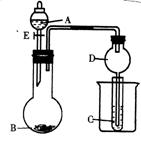
⑴ 若A为醋酸,B为石灰石,C为C6H5ONa溶液,则在 小试管中发生的现象是
________________________________________________________________________,
其中发生反应的化学方程式为__________________________________________。
⑵若B为生石灰,实验中观察到C溶液中先产生沉淀,而后沉淀逐渐溶解。当沉淀恰好溶解时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁上出现银镜。则A是_________,C是__________和乙醛的混合液,发生银镜反应的化学方程式为________________________________________________仪器D在实验中的作用是__________________________________________________。
7.(18分)在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
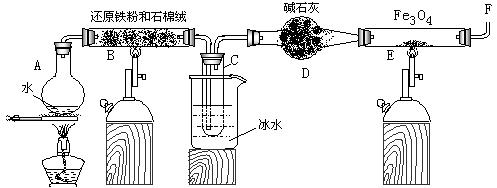
(1) 烧瓶A中常加入碎瓷片,其作用是 ,
小试管C的作用是 。
(2) 为了安全,在E管中的反应发生前,在F出口处必须 ,
E管中的反应开始后, 在F出口处应 。
(3) 反应3Fe +4H2O(g) ![]() Fe3O4
+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
Fe3O4
+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释
。
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中
含有Fe3+的实验操作及现象
。
8.(18分)利用如图所示的装置验证稀硝酸被铜还原的产物是NO而不是NO2:
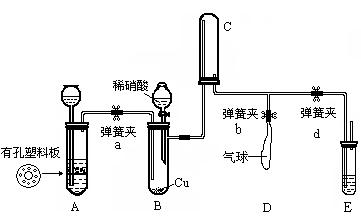
(1)空气对实验影响很大。为了预先除去装置中的空气,在A装置中产生的气体是_________,检验装置中的空气已被除净的方法是___________________
_____________________________;E中应加入的试剂是________________;
(2)关闭弹簧夹a和d,打开b,由分液漏斗向试管B中滴加稀硝酸,装置C中的气体呈__________色,装置D的作用是_____________________________; 关闭弹簧夹d的目的是____________________________________________;
(3)将A 装置换成鼓气球,鼓入少量空气,C中气体的颜色变为________色,此时弹簧夹b应打开,d应________(填“打开”或“关闭”);
(4)实验结束时,如何操作才能使装置中的有毒气体被E中的溶液充分吸收?
________________________________________________________________。
9.(12分)某校化学小组学生进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。
步骤如下
|
|
|
| ||||||||
| ||||||||
步骤①观察到的现象是 。步骤③的主要操作包括: 。
(2)硫酸铜溶解度的测定。
用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式是 。已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是 。
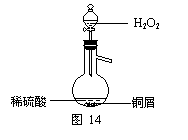 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如右图,验证该实验,该反应的化学方程式是
。
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如右图,验证该实验,该反应的化学方程式是
。
若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得到的结论是
。
10.(12分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
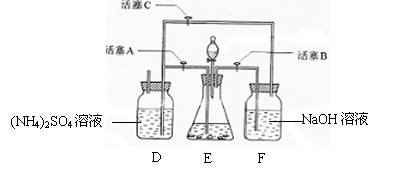
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
参考答案:1.(1)a bf gc d或b af gd c(其它合理答案均给分)…………………(2分)
(2)②④⑤①③ ………………………………………………………………(2分)
(3)防止装置中空气与CO的混合气受热时发生爆炸;……………………(2分)
检验CO2是否已除净;……………………………………………………(2分)
证明有新的CO2生成,并说明乙二酸分解产物中有CO ………………(2分)
(4)5:7 …………………………………………………………………………(2分)
(5)在装置A与D之间加一个装有一定量水(或乙醇)的洗气瓶。(说明:A、D之间缺少一个吸收草酸蒸汽装置,草酸也可以使氢氧化钡溶液变浑浊)…(2分)
2.(15分)(1)①乙醇(2分);cab(或acb)(2分)
②有红色沉淀产生(2分)
③取2mL的10%的NaOH溶液放入试管中,用胶头滴管滴入4滴~6滴2%的CuSO4溶液,振荡
(答“向NaOH溶液中滴加少量CuSO4溶液”得1分,无“少量”不得分)(2分)
(2)①向烧杯中注入水,在78.5℃以上水浴加热。
|
② (2分,有错不得分);
氧气与氢结合生成水,使平衡向正反应方向移动(2分)
3.(16分)
![]() (1)(2分)SO2(g)
+
(1)(2分)SO2(g)
+ ![]() O2(g) SO3(g);△H = -98.3kJ/mol
O2(g) SO3(g);△H = -98.3kJ/mol
(2)(2分)给催化剂加热 (3)(各2分)提高二氧化硫的转化率;吸收SO3;b
(4)(2分)继续通入氧气一段时间
(5)(4分)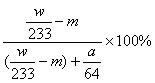
4. (1)![]() (3分)
(3分)
(2)①可以控制反应。②吸收NO2气体,防止污染环境。(4分)
(3)关闭c;打开a、b。(4分)
(4)先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)②试管。(合理答案均给分)(4分)
(5)![]() (3分)
(3分)
5. (1)说明:每个选项1分…………………………………………………………………5分
| 选择的装置(填序号) | f | b | |
| 选择的药品(填序号) | ②⑥ | ④ |
(2)方案1:塞紧单孔塞,(1分)关闭开关,(1分)将烧杯中加入一定量水使干燥管下端管口浸没在水中(1分),如果干燥管内外液面有一定高度差,说明装置的气密性良好(1分)。
方案2:塞紧单孔塞,关闭开关,将烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好(其他方案合理均给分)。 ……………………………………4分
(3)![]() (或氯化氢)(每空2分)…4分
(或氯化氢)(每空2分)…4分
(4)使溶液中的NaOH完全转化为![]() ……………………………………2分
……………………………………2分
![]() ……………………………………2分
……………………………………2分
![]()
4.4%(4.39%或4.41%)……………………………………………………………3分
6.Ⅰ.(8分)⑴ NO
⑵①C2H4 装置中没有温度计,无法控制反应温度
②Cl2 反应生成的Cl2 被c中的NaOH溶液吸收了
③NH3 反应生成的NH3被c中的水吸收了
Ⅱ.(8分)
⑴ 溶液变浑浊,C6H5ONa + CO2 + H2O →C6H5OH +NaHCO3
⑵ 浓氨水,硝酸银,CH3CHO + 2Ag(NH3)2OH → CH3COONH4 +2Ag↓+3NH3 +H2O防止试管中液体发生倒吸
7.(18分)
(1) 防止液体暴沸 (2分) 冷凝水蒸气(2分)
(2) 检验氢气的纯度(2分) 点燃氢气(2分)
(3) 实验中不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行(2分)
(4) 取滤液少量,向其中滴加KSCN溶液, 溶液变为血红色,即证明含有Fe3+(2分)
8.(18分)(每空2分)
(1)H2、在E的出口处检验氢气纯度;氢氧化钠溶液
(2)无、储存气体;防止一氧化氮逸出(3)红棕;关闭
(4)鼓入足量空气后再将弹簧夹d慢慢打开,继续鼓气直至装置中的气体颜色完全褪去(其他合理答案可得分)
9.(12分)(1)红色固体变黑; 加热浓缩,冷却结晶,过滤………(各2分,共4分)
(2)Cu2++2e-==Cu 20 g………(各2分,共4分)
(3)Cu+H2O2+H2SO4=CuSO4+2H2O 铜屑放入H2O2中不发生反应,若在H2O2中加入稀硫酸,铜屑可逐渐溶解。………(各2分,共4分)
10.(12分)
(1)除去混在氢气中的酸性气体(2分)
(2)A B、C (各1分,共2分)
将E中的产生的硫酸亚铁溶液压入D中(2分)
(3)②(2分)
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案(每空2分,共4分)