选择题训练(44)
一、选择题(每小题只有一个正确答案,每小题4分,8小题共32分)
1.化学与材料科学息息相关,从一定意义上讲,材料是科学技术的先导,没有新材料的发展,就不可能使新的科学技术成为生产力。下列有关材料的说法不正确的是
A.材料是为人类社会所需要并能用于制造有用器物的物质
B.人类使用和制造材料有悠久的历史,制造出的第一种材料是陶
C.体型结构的酚醛树脂制成的塑料,加工成型后,受热熔化后可以制成其它形状的器物
D.高分子分离膜是具有传统高分子材料的机械性能,又具有特殊分离功能的功能高分子材料制成的薄膜
2.下列有关物质分类或归类正确的是
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、石炭酸
④同素异形体:C60、C70、金刚石、石墨
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯
A.①③④ B.②③④ C.③④ D.②④⑥
3. 关于氢键,下列说法正确的是
A.分子间形成的氢键使物质的熔点和沸点升高
B.冰中存在氢键,水中不存在氢键
C.每一个水分子内含有两个氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
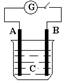 4.如图所示,把A、B插入C的溶液中,闭合电键K后检流仪G的指针会发生偏转,且B上有大量气泡产生,则A、B、C可能是以下哪一组物质
4.如图所示,把A、B插入C的溶液中,闭合电键K后检流仪G的指针会发生偏转,且B上有大量气泡产生,则A、B、C可能是以下哪一组物质
A. A—Cu B—Zn C—CuSO4
B. A—Ag B—Fe C—HCl
C. A—石墨 B—Zn C—H2SO4
D. A—Zn B—石墨 C—H2SO4
5.下列有关说法正确的是
A.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
B.在氢氧化铁胶体中加入过量盐酸最终会产生沉淀
C.用结晶法可以除去硝酸钾中混有的少量氯化钠
D.用酒精可以提取碘水中的碘
6.下列物质能使品红溶液褪色,且褪色原理基本相同的是:
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤ C.②④⑤⑥ D.①②③④⑤⑥
7.关于工业生产的下列叙述中,不正确的是
A.工业上采用电解熔融氯化铝的方法制取金属铝
B.工业上用用离子交换膜法制烧碱
C.工业上合成氨时,采用2×107Pa~5×107Pa,而没有采用更大压强是从设备和动力要求方面考虑的
D.工业生产硫酸时,在接触室中使用热交换器可以充分利用反应中所放出的热量
8.甲醛、乙酸和2-羟基丙醛组成的混合物中0元素的质量分数为37%,则其中H元素的质量分数为
A.9% B.12% C.16% D.20%
二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9.用脱脂棉包住0.2gNa2O2粉末,放在石棉网上,在脱脂棉上滴加几滴水;可以观察到脱脂棉剧烈燃烧起来。由实验现象所得出的结论正确的是
A.Na2O2与H2O反应是一个放热反应
B.Na2O2与H2O反应中有氧气生成
C.Na2O2与H2O反应中有氢氧化钠生成
D.Na2O2与H2O反应中有中间产物H2O2生成
10.某温度下,反应2NO2![]() N2O4;△H<O。在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变条件的可能有
N2O4;△H<O。在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变条件的可能有
A.保持容器容积和温度不变,向容器内补充了NO2
B.保持容器容积和温度不变,向容器内补充了N2O4
C.保持温度压强不变,向容器内补充了N2
D.保持容器的容积不变,升高了温度
11.用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.在反应CaO+3C高温CaC2+CO↑中生成1molCO,电子转移数为3 NA
B.常温时,2L1mol/L的甲酸溶液中,所含分子总数小于2NA
C.1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
D.1molNH2—中含电子数为10 NA
12.下列离子方程式书写正确的是
A.将少量AgNO3溶液滴入氨水中
Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
B.将少量SO2通入NaClO溶液中
SO2+2ClO—+H2O=SO32—+2HClO
C.大理石上泼上醋酸
CaCO3+2H+=Ca2++H2O+CO2↑
D.含有0.1molFeI2的溶液中通入标准状况下2.24LCl2
2Fe2++2I—+2Cl2=2Fe3++I2+4Cl—
13.温度不变时,在盛有饱和碳酸钠溶液的烧杯中,插入石墨做电极,通直流电一段时间后,下列说法不正确的是
A.碳酸根离子的水解程度不变
B.钠离子和碳酸根离子的物质的量浓度的比值将变小
C.溶液的pH不发生变化
D.溶液的浓度逐渐增大,有一定量晶体析出
14.目前工业生产H2O2的一种新方法的生产过程中,会生成一种中间产物,其结构简式为: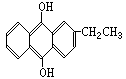 。有关该物质的说法正确的是
。有关该物质的说法正确的是
A.它属于芳香族化合物 B.它是苯的同系物的含氧衍生物
C.它可发生消去反应 D.它可与NaOH溶液反应
15.常温下,有甲、乙两份体积均为1L浓度为0.1mol/L的氨水,其pH为11。
⑴甲用蒸馏水稀释100倍后,溶液的pH将为 ;
⑵乙与等体积,浓度为0.2mol/L的HCl混合,则混合溶液中,n(NH4+)+n(H+)-n(OH—)= mol
正确的答案组合是
A.9~11之间 0.1 B.9~11之间 0.2
C.12~13之间 0.2 D.13 0.1
16.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O2+2H2O=4NaOH+O2↑
B.CaC2+2H2O→Ca(OH)2+CH![]() CH↑
CH↑
C.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
D.NH4Cl+NaOH加热NaCl+H2O+NH3↑
17.测得某一溶液中仅含有Na+、Mg2+、Cl—、SO42—-四种离子,其中Na+和Mg2+的个数比为4∶5,则Cl—和SO42—的个数比可能为①8∶3 、 ②1∶3 、 ③4∶1 、 ④3∶2 ,其中正确的是
A.只有① B.只有①②④ C.只有②④ D.①②③④
18.物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
A.c(Na+)+ c(H+)= c(X—)+ c(OH—)
B.c(HX )+ c(X—)= c(Na+)
C.若溶液呈酸性,则c(X—)>c(Na+)>c(HX)>c(H+)>c(OH—)
D.若溶液呈碱性,则c(Na+)>c(HX)> c(X—)>c(OH—)>c(H+)