高中毕业班化学教学质量检测试题
化 学 试 题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
第Ⅰ卷(选择题 共46分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考试号、考试科目涂写在答题卡上。
2.每题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,不能答在试题上。
可能用到的相对原子质量:H:1 C:12 O: Mg:24
一、选择题(本题包括18个小题,1~8题每小题2分,9~18题每小题3分,共46分。每小题只有一个选项符合题意)
1.威海的城市建设日新月异,高楼林立,马路宽阔,绿树成荫,鸟语花香。你是否注意到,马路两旁的许多树干上都抹上了白石灰。下列有关说法不正确的是 ( )
A.氢氧化钙显碱性,能使蛋白质变性,所以有防治树木病虫害作用
B.利用白石灰的反光作用,降低晴天吸热,减少昼夜温差,预防树皮冻裂
C.饱和石灰水加入生石灰,若温度不变,则pH不变
D.饱和石灰水加入生石灰,若温度不变,则Ca2+的物质的量不变
2.有关化学用语正确的是 ( )
|
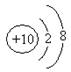
C.乙醛的结构简式CH3COH D.钠离子的结构示意图为
3.据报道,2006年11月一名俄罗斯前特工在英国因钋中毒而死亡。已知钋单质为银白色金属,在黑暗中能发光,它有两种不同结构的单质α—Po和β—Po,钋元素有质量数从192到218的全部核素,其常见化合价为+2、+4、+6。下列关于钋的叙述错误的是( )
A.钋元素的放射性元素 B.α—Po和β—Po是钋元素的同素异形体
C.![]() 互为同位素 D.210Po和218Po为两种不同的元素
互为同位素 D.210Po和218Po为两种不同的元素
4.下列各组离子一定能大量共存的是 ( )
A.在强碱溶液中:Na+、K+、AlO2-、CO32-
B.在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
C.在c (H+) = 10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH = 1的溶液中:K+、Fe2+、Cl-、NO3-
5.根据相关化学原理,下列判断正确的是 ( )
A.若X的质子数为a,中子数为b,则X的质量数为:a—b
B.若A2 + 2D-→2A- + D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R> M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA < NaB
| |
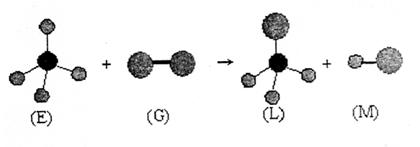
|
A.上述反应的类型是取代反应 B.E分子中两个键的夹角是90°
C.干燥的G单质是漂白性 D.常温常压下,L是一种液态有机物
|
8.一定温度下,用水稀以c mol·L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是 ( )
A.c (CH3COO-)/c (CH3COOH) B.c (CH3CHOOH)/c (H+)
C.c (H+)/c (OH) D.c (H+)/Kw
|
![]() 2NO2(g) 2NO(g)+O2(g);△H>0,
2NO2(g) 2NO(g)+O2(g);△H>0,
达到平衡。当改变其中一个条件X,Y随X
的变化符合图中曲线的是 ( )
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示NO2的物质的量
10.已知,同温度下的溶度积:Zn(OH)2>ZnS,MgCO3 > Mg(OH)2;就溶解或电离出S2-的能力而言,FeS > H2S > CuS,则以下离子方程式错误的是 ( )
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg (OH)2↓+2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn (OH)2↓+H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
11.草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是 ( )
A.c (K+) + c (H+) = c (HC2O4-) + c (OH-) + c (C2O42-)
B.c (C2O42-) > c (H2C2O4)
C.c (HC2O4-) + c (C2O42-) = 0.1mol·L-1
D.c (K+) = c (H2C2O4) + c (HC2O4-) + 2c (C2O42-)
12.能够使反应Cu + 2H2O = Cu (OH)2+ H2↑发生的是 ( )A.用铜片作阴、阳电极,电解氯化铜溶液
B.用铜片作阴、阳电极,电解硫酸钾溶液
C.铜锌合金在潮湿空气发生电化学腐蚀
D.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
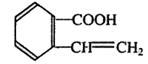
13.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是 ( )
|
B.若R1、R2为—CH3,是其化学式为C12H16
C.若R1 = R2,一定条件下烯烃双键碳原子上
的氢也能取代,则始祖鸟烯环上的二氯代
| |
D.始祖鸟烯既能使酸性高锰酸钾褪色也能使
溴水褪色,其褪色原理是一样的
14.常温下,pH = 12的一元弱碱和pH = 1的一元强碱酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法正确的是 ( )
A.反应后溶液呈酸性 B.弱碱的浓度小于强酸的浓度
C.弱碱中的OH-的浓度为0.1mol·L-1 D.弱碱的浓度大于强酸的浓度
15.短周期元素X、Y的原子序数相差2。下列有关叙述正确的是 ( )
A.X与Y不可能位于同一主族 B.X与Y一定位于同一周期
C.X与Y不可能形成共价化合物XY2 D.X与Y可能形成离子化合物XY
16.“酸化”是实验中经常采用的方法,下列酸化过程正确的是 ( )
A.提高高锰酸钾的氧化能力,用盐酸酸化
B.抑制Fe2+的水解,用稀硝酸酸化
C.检验氯化烃中含氯,加碱溶液加热后,用稀硫酸酸化,再检验
D.确认溶液中含有SO42-时,用盐酸酸化,再检验
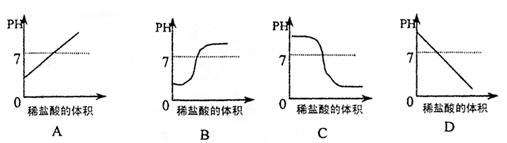
17.向盛有10mlLNaOH溶液的烧杯中逐滴滴加稀盐酸,下列图像能够体现溶液的PH变化情况的是 ( )
|
![]() 18.某密闭容器中进行如下反应:2X (g) + Y (g) 2Z (g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
18.某密闭容器中进行如下反应:2X (g) + Y (g) 2Z (g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
第Ⅱ卷(非选择题 共54分)
二、(本题包括2小题,共19分)
19.(9分)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知
CH3OH(1) + O2(g) = CO(g) + 2H2O(g) △Ha =-443.64kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △Hb =-566.0kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(汽)的热化学方程式:
(2)有人认为:在一定条件下,完全可实现由CO2和H2O(汽)来制取CH3OH(1)的反应,从而能缓解能源紧张和温室效应的问题。试通过计算说明,这种反应是否具有可行性?
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
|
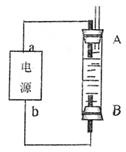
(4)利用电池可实现电能向化学能转化。某同学设计了
一种电解法制取Fe(OH)2的实验装置,通电后,溶
液中产生大量的白色沉淀,且较长时间不变色。
下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
|
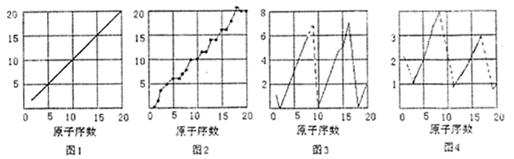
(1)图1—图4的纵轴数值分别代表 、 、 、
。
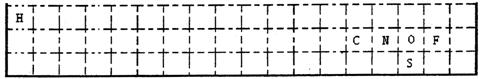
(2)其中已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:①a + b = c,②(b + d)/ 2 = c,③(c + e)/ 2 = d,请根据提供的信息,回答下列问题:
|
表前三周期的边界,
请将A—G六种具
体元素符号填在表
中相应位置。
②写出铜与上述某一元素最高价氧化物对应的水化物反应的化学方程式(任写一个)
③写出上述元素形成的物质之间能够发生置换反应的化学方程式(任写一个)
三、(本题包括2小题,共11分)
21.(3分)下列说法不正确的是
①称量时,所称量物均放在纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
②漂白粉、苯酚、水玻璃、烧碱露置在空气中易变质的,应密封保存
③不慎将浓碱溶液沾到皮肤上,要立即用大量的水冲洗,然后涂上硼酸溶液
④配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
⑤给试管里的液体加热时,试管口应略向上倾斜(约45°角),外壁干燥后再预热
⑥使用pH试纸时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
|
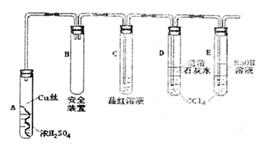
反应,设计了如右图所示的实验探究方案(装
置中的固定仪器和酒精灯均未画出)。
以下是该学习小组部分交流记录及后续探究
实验的记录
实验1:加热后,液面下铜丝变黑,产生气
泡,一段时间后液面以上的铜丝也发黑,而
且试管上部内壁有少量淡黄色硫固体凝聚,
持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化,将浓硫酸液面上方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3:将浓硫酸液面上方铜丝的黑色物质刮下后,经稀硫酸洗、蒸馏水洗、过滤、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量比加热前减少。
 |
【问题探究】
(1)A试管上方的长导管的作用是 ;D、E两试管中CCl4的作用是 。
(2)写出淡黄色固体物质消失的化学方程式 。
(3)试管D中的澄清石灰水变浑浊后又变澄清,变澄清的原因是(用方程式表示)
。
(4)根据上述探究,结合资料卡上的内容,你认为液面下方铜丝表面的黑色物质成分肯定有 。
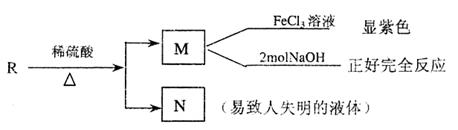
四、(本题包括2小题,共16分)
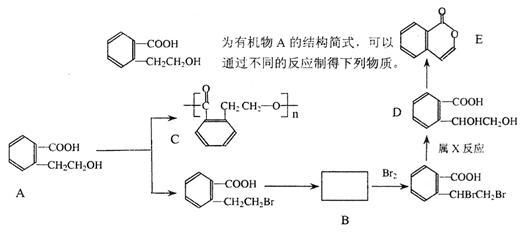
|
(1)写出A→C的化学方程式:
。
(2)推断B物质的结构简式: 。
X反应类型是 ;由D→E所需的试剂是 。
|
试写出符合条件的R的同分异构体的结构简式(任写两种);
;
。
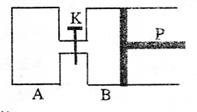
24.(8分)
![]()
|
试回答下列问题:
(1)A、B两容器达到平衡的时间:
tA tB(填“大于”、“小于”或“等于”)
(2)平衡时,B中Y的转化率为 ;
反应的平衡常表达式KB = ;
当A、B分别达到平衡时,两容器中物质W
的百分含量关系是:A B(填“大于”、“小于”或“等于”)。
(3)如果要计算平衡时B的混合气体的密度,则至少还需要知道的数据是
(MX、MY、MZ、MW分别代表X、Y、Z、W的摩尔质量)
①MX ②MY ③MZ ④MW
A.②和④ B.①和② C.①和③ D.②和③
(4)打开K,一段时间后反应可再次达到平衡,则引时B的体积为 L。
五、(本题包括1小题,共8分)
25.(8分)金属镁是银白色,但镁带表面呈现灰黑色。用砂纸磨下镁带表面固体粉末,隔绝空气加强热,有水气生成;另取粉末,加入稀酸,产生气体导入澄清石灰水中,产生混浊。
(1)为确定其组成,将镁带表固体粉末2.84g隔绝空气加强热,产物先用浓硫酸吸收,再用碱石灰吸收,剩余白色固体。浓硫酸增重0.36g,碱石灰增重0.88g,请通过计算确定该组成的化学式。
(2)如果将这种灰黑的镁条在纯氧中点燃,燃烧产物中有黑色物质生成,这种黑色物质的成份是什么?并说明形成的原因。
参考答案
注意:1、凡元素符号、化学式有错,及化学专用词语出现错别字的,有关内容不得分。
2、各种化学方程式没有配平的,均不得分。
3、答题时,若只答出含义而未答出要点的,有关内容不得分;没有用化学专用词语答题者,有关内容不得分。
一、选择题(本题包括18小题,46分1 – 8每小题2分,9 – 10每小题3分,每小题只有一个选项符合题意)
1.D 2.B 3.D 4.A 5.D 6.A 7.C 8.A 9.B
10.C 11.B 12.B 13.C 14.A 15.D 16.D 17.C 18.C
19.(9分)
(1)2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =-1453.28kJ·mol-2(2分)
(2)若发生2CO2(g) + 4H2O(g) = 2CH3OH(1) + 3O2(g)反应,其△H =-1453.28kJ·mol-1>0由于反应后气相物质的量减少,△S<0,所以△H-T△S>0故反应不能自发进行,此反应不具有可行性。(2分)
(3)负极(1分) CH3OH + 8OH--6e-= CO32-+ 6H2O (2分)
(4)B、D (2分)
20.(10分)
(1)质子数;中子数;最高正价;得电子相对能力(4分,每空1分)
|
![]()
![]() 3Cu + 8HNO3(稀) 3Cu (NO3)2
+ 2NO↑+ 4H2O或Cu + 4HNO3(浓) Cu(NO3)2
+
3Cu + 8HNO3(稀) 3Cu (NO3)2
+ 2NO↑+ 4H2O或Cu + 4HNO3(浓) Cu(NO3)2
+
2NO2↑+ 2H2O或Cu + 2H2SO4(浓) CuSO4 + SO2↑+2H2O等(2分)
![]()
![]() 2H2S
+ O2
2S + 2H2O
2F2 + 2H2O 4HF + O2
2H2S
+ O2
2S + 2H2O
2F2 + 2H2O 4HF + O2
4NH3 + 3O2 2N2 + 6H2O等(2分)
21.①④⑥ (3分,每少一个扣1个,错一个倒扣1分,扣完为止)
22.(8分)
(1)冷凝、回流,防止倒吸
![]() (2)S + 2H2SO4(浓) 3SO2↑+ 2H2O
(2)S + 2H2SO4(浓) 3SO2↑+ 2H2O
(3)CaSO3 + SO2 + H2O = Ca (HSO3)2
(4)CuO、CuS (除第一问每空1分,其余每空均为2分)
|
(1)
…………2分
|
(2) (2分)取代反应(1分) 浓硫酸 (1分)
|
(3)
(各1分,其他合理答案也可)
24.(8分)
(1)大于 (1分)
(2)75%(1分)K(B)=[Z]2[W]2/[X]2[Y]3 (1分) 小于 (1分)
(3)B (2分)
(4)0.2a(2分)
25.(8分)
(1)①加入稀酸有二氧化碳生成说明该物质中有碳酸根。
②由题意知:该反应为分解反应,生成水、二氧化碳和氧化镁,反应生成氧化镁的质量为2.84g-0.36g-0.88g = 1.6g,物质的量为0.04mol ………………………………2分
且反应生成水的质量为0.36g,物质的量为0.02mol;反应生成二氧化碳的质量为0.88g,物质的量为0.02mol; ……………………………………………………………… 1分
所以原物质中Mg、H、O、C的原子个数比为2:2:5:1
则该物质的化学式为Mg2(OH)2CO3 (其他表示形式如果合理也可得分) ………2分
(2)碳(1分);其产生的原因:镁与分解产生的CO2反应生成氧化镁和碳。……2分