高中毕业班化学第二次联考试题
化 学
命题者:沅江一中(廖旦初)南县一中(庄农)桃江一中(詹奇寿)
时量:90分钟 满分:108分
相对原子质量表:H:1 C:12 O:16 Na:23 Cl:35.5
第Ⅰ卷(48分)
选择题(每题3分,共48分。只有一个选项合乎题意,请将你的答案填在后面的表里。填在其它地方的视为无效答案)
1. 我国60岁以上的老年人已超过1.3亿,老年人的长寿和抗衰老问题已受 社会的关注。已知对人类长寿有益的微量元素有锌、硒、铜、锰、钼、铬等,其中属主族元素的是
A.锌 B.硒 C.铜 D.都不属于主族元素
2. 采用循环操作可提高原料利用率,下列工业生产中,采用循环操作的是
A.水泥 B.合成氨 C.石油裂化 D.氯碱工业
3. 在下列各种用途中,利用了物质氧化性的是
A.用食盐腌渍食物 B.用二氧化硅做光导纤维
C.用汽油擦洗衣料上的油污 D.用漂粉精消毒游泳池中的水
4. 设NA表示阿伏加德罗常数,下列说法中正确的是
A.0.3mol NO2溶于水,转移电子数为0.1NA
B.0.1mol —CH3含NA个电子
C.标准状况下,7.1g氯气含0.1NA个Cl2分子
D.标准状况下11.2L SO3中含1.5NA个氧原子
5. 下列说法或表示法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石);△H=+119kJ•mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H++OH-= H2O;△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的烧碱溶液混合,放出的热量大于57.3kJ
D.1L 0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热:H2SO4(aq)+2NaOH(aq) = Na2SO4(aq)+2H2O(1);△H=-57.3kJ/mol
6.
将![]() 通入
通入![]() 溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则另一气体可能是
溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则另一气体可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
7. 一种正在投入生产的大型蓄电系统,总反应式为:
![]() 作为负极反应的物质是
作为负极反应的物质是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.
1962年,英国青年化学家巴特来特将PtF6和Xe按等物质的量之比在室温下混合后,首次制得含有化学键的稀有气体化合物六氟合铂酸:
Xe + PtF6
= XePtF6 有关此反应的叙述中,正确的是:
A. Xe是氧化剂 B.PtF6是氧化剂
C.PtF6既是氧化剂又是还原剂 D.该反应是非氧化还原反应
9. 下列离子方程式书写正确的是
A.碳酸钠溶于水:![]()
B.向![]() 粉末中加入足量HI溶液:
粉末中加入足量HI溶液:![]()
C.向![]() 溶液中加入过量盐酸:
溶液中加入过量盐酸:![]()
D.将Mg粉加入![]() 溶液中:
溶液中:![]()
10. 将等物质的量的镁和铝相混合,平均分成4份,分别加到足量的下列溶液各100 mL中,充分反应后,放出氢气最多的是
A. 3 mol·L-1 HCl B. 4 mol·L-1 HNO3
C. 8 mol·L-1 NaOH D. 18 mol·L-1 H2SO4
11. 室温下,物质的量浓度均为0.01mol·L-1的HA和MOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH为
A.≥7 B.一定>7 C.≤7 D.可能=7
12. 化学实验中,常将溶液或试剂酸化,下列酸化处理的措施中正确的是
A.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
C.检验某溶液中是否含Cl – ,用HNO3酸化的AgNO3溶液
D.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
13. 在常温下,下列可逆反应的平衡移动伴随着颜色变化,但颜色变化不受压强变化的是:
A、2NO2![]() N2O4;
B、2NO2
N2O4;
B、2NO2![]() 2NO+O2;
2NO+O2;
C、2HI![]() H2+I2; D、FeCl3+3KSCN
H2+I2; D、FeCl3+3KSCN![]() Fe(SCN)3+3KCl
Fe(SCN)3+3KCl
14. 若某有机物中一个碳原子以单键形式连有四个不同的原子或原子团时,该原子被称为手性碳原子。具有手性碳原子的物质常具有光学活性,如有机物![]() 具有光学活性。该有机物发生下列反应后,不会失去光学活性的是
具有光学活性。该有机物发生下列反应后,不会失去光学活性的是
A.与银氨溶液反应 B.与NaOH水溶液反应
C.与浓硫酸、乙酸共热 D.与灼热的CuO反应
15.  右上图中a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是
右上图中a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的性质最稳定
C.b、d气态氢化物溶于水,溶液的酸性:b > d
D.e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐
16. 据测定,指示剂酚酞的结构简式可表示为下图:,下列说法不正确的是
 A.酚酞的分子式为C20H14O4
A.酚酞的分子式为C20H14O4
B.酚酞可与FeCl3溶液发生显色反应
C.1 mol酚酞与H2完全加成,最多可消耗10 mol H2
D.1 mol酚酞与NaOH溶液共热,最多可消耗
3 mol NaOH
毕业班第二次联考化学试题
第Ⅰ卷选择题答案栏
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷(60分)
(本卷七个大题,每空2分)
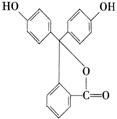
17. (10分)气体A只含X、Y两短周期元素,X的原子序数>Y的原子序数。B、D、E是中学化学中的常见气体。乙为黑色、F为红色、C为液体。各物质有如下图所示的转化关系。试回答下列问题:
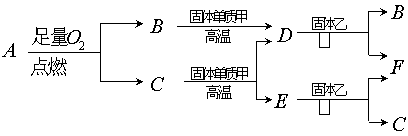
(1)若气体A中,X与Y元素的质量比![]() <3,则气体A中肯定有(写化学式)
。
<3,则气体A中肯定有(写化学式)
。
(2) 若气体A为单一气体且其分子为直线型结构,又知A中X与Y两元素的质量比在数值上等于X的相对原子质量,
A的电子式为 ,C在固态时属 晶体。
(3)C与甲在高温下反应的化学方程式为:
。
(4)F溶于稀![]() 的离子方程式为:
。
的离子方程式为:
。
18. (8分)合成氨工业对化学工业和国防工业具有重要意义,对我国实现农业现代化起着重要作用。根据已学知识回答下列问题:已知:
|
(1)合成氨工业中采取的下列措施不可用勒沙特列原理解释的是
(填序号)
A、采用较高压强(20Mpa~50Mpa) B、采用500℃的高温
C、用铁触媒作催化剂 D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)1998年两位希腊化学家在《科学》杂志上发表论文,称他们在常压下把氢气和用氦气稀释的氮气分别通人一个加热到570℃的电解池(图1)中,氢和氮在电极上合成了氨,且转化率达到了78%。用来合成氨的电解质在电解池里起传导H+离子的作用(见图1),它是一种固体复合氧化物(缩写为SCY),具有钙钛矿晶体构型(最小重复单元见图2),电解池的两个电极则是吸附在SCY内外表面上的金属钯多晶薄膜。
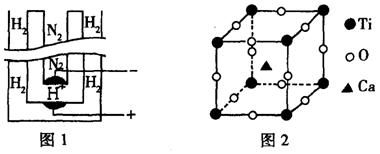
①阴极的电极反应方程式为____________________________
②钙钛矿晶体中,每个钛原子周围与它最接近且等距离的钛原子共有
个,氧、钙、钛(Ti)的原子个数比是
。
19. (6分)实验室常用的几种气体发生装置如图所示:
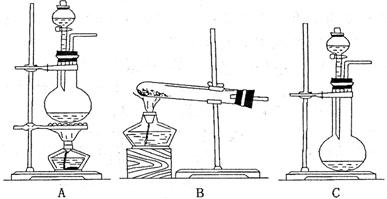
(1)实验室利用双氧水和二氧化锰制取氧气,应选装置 。(填字母)
(2)现有两种方法制取氨气,可供选用的药品有:①熟石灰, ②生石灰 ,③硫酸钠 ,④小苏打, ⑤氯化铵, ⑥电石, ⑦ 浓氨水, ③饱和食盐水, ⑨浓硫酸等。(填序号)
第一种方法是选择装置B,则需选用的试剂为 ;
第二种方法是选择装置C,则需选用的试剂为 ;
20. (10分)乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 100℃ |
请回答下列问题:
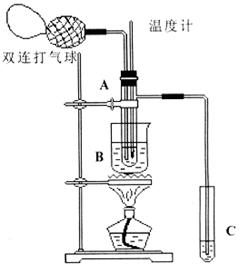 (1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)
__________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;当试管A内的主要反应完成后温度计水银球的位置应在___________________;
(3)烧杯B内盛装的液体可以是_______
供选择的试剂有;
乙酸; 甘油; 水
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、酚酞试液、碳酸氢钠粉末。实验仪器任选。
该方案为________________________________________________________。
____________________________________________________
21.
(10分)已知:①R—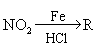 —
—![]()
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响.
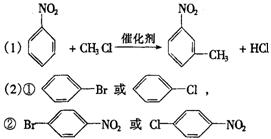
用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是______________________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:①___________________,②____________________。
(3)B在苯环上的二氯代物有 种同分异构体。
(4)有机物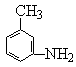 至少有 个原子在同一平面上。
至少有 个原子在同一平面上。
22. (8分)现有只含![]()
![]()
![]() 的溶液,欲使其变成只含
的溶液,欲使其变成只含![]()
![]()
![]() 的溶液,可采取下列方法,试写出有关物质的化学式。
的溶液,可采取下列方法,试写出有关物质的化学式。
(1) 只加入0.5![]()
![]() 的纯净物A,
的纯净物A,
则A可能是 或 。
(2)只加入![]()
![]() 的纯净物B,
的纯净物B,
则B可能是 或 。
23. (8分)有两份溶液,其中所含溶质相同,设其摩尔质量为M g/mol。
根据下表信息,回答有关问题:
| 溶质的质量分数 | 溶液的密度(g·cm-3) | |
| 第一份溶液 | w1 | d1 |
| 第二份溶液 | w 2 | d2 |
(1)第一份溶液中,溶质的物质的量浓度为_______________________。
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数w 3=________。
(3)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,试比较w3、w4的相对大小?______________________; ___________________________。
毕业班第二次联考试题
化学答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | B | D | C | C | B | A | B |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| C | A | B | C | D | A | D | C |
17:⑴H2 ⑵![]() 分子晶体 ⑶C+H2O
分子晶体 ⑶C+H2O![]() CO+H2 ⑷ 3Cu + 8H+ +2NO— 3== 3 Cu2+
+2NO↑+ 4H2O
CO+H2 ⑷ 3Cu + 8H+ +2NO— 3== 3 Cu2+
+2NO↑+ 4H2O
18:(1)BC (2)① N2 + 6H+ + 6e- = 2NH3
②12个 3:1:1
19 (1)C (2) ①⑤或②⑤(选一组即可) ②⑦
20(1)![]()
(2)试管A的反应液中 与试管A的支管口处相平
(3)甘油
(4)方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸。
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成(答案合理均正确)。
21. 
(3)6 (4)12
22 (1) Na2O Na2O2 (2) Na NaOH (写NaAlO2 或 NaH也可)
23.(1)1000ρ1w1/M mol/L (2)(w1+w2)/2
(3)①若d1>d2,w4>w3;②若d1<d2,w3>w4
