高中毕业班化学第二次质量检查试题
理综卷(化学部分)
相对原子质量:H—l、C—12、N一14、O—16、S一32
一、选择题(本题包括8小题。每小题只有一个选项符合题意)
6.下列叙述正确的是 ( )
A.糖类、油脂和蛋白质都是天然高分子,也是人类重要的营养物质
B.胶体中的胶粒直径在1纳米 ~ 100纳米之间,与纳米材料相吻合,因此胶体都是纳米材料
C.水的相对分子质量比硫化氢小,但水的沸点却比硫化氢高,这主要是因为水分子间存在氢键
D.放热反应都可以通过原电池装置将其化学能直接转化为电能
7.下列各溶液中的离子组能大量共存的是 ( )
A.pH = 0的溶液中:K+、Fe2+ 、Cl-、NO3-
B.强碱性溶液中:Na+、K+、AlO2-、CO32-
C.c ( H+) = c (OH- )的溶液中:Na+、Ba2+、C1-、SO42-
D.使蓝色石蕊试液变红的溶液中:Na+、K+、SO32-、HCO3-
8.将足量的SO2气体持续通入下列各溶液,最终有沉淀产生的是 ( )
A.Ba (NO3 )2 B.BaCl2 C.Ba (OH )2 D.NaHCO3
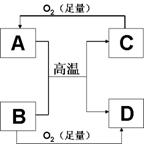 9.右图所示的反应均是在高温或引燃后进行。选项中的物质
9.右图所示的反应均是在高温或引燃后进行。选项中的物质
表示A和B,不合理的是 ( )
A.CO2、Mg B.MgO、Al C.Fe3O4、Al D.CuO、H2
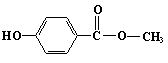 10.尼泊金甲酯常用作化妆品防腐剂,其结构简式为
10.尼泊金甲酯常用作化妆品防腐剂,其结构简式为
下列关于尼泊金甲酯的叙述,错误的是 ( )
A.分子式是C8H8O3
B.分子内所有的原子可能都在同一平面上
C.和NaOH溶液反应,1mol尼泊金甲酯消耗2mol NaOH
D.尼泊金甲酯的同分异构体中,苯环直接连着羟基和羧基的有10种
|
Cu2S + 2Cu2O ===== 6Cu + SO2↑
关于此反应的说法正确的是 ( )
A,该反应有三种元素的化合价发生变化
B.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物
 D.每生成0.1mol
Cu,转移0.2 mol电子
D.每生成0.1mol
Cu,转移0.2 mol电子
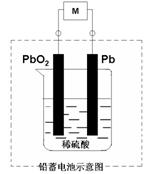
12.铅蓄电池是一种典型的可充电电池,电池总
反应式为
![]() Pb + PbO2 + 4 H+ +2SO42-
PbSO4 + 2 H2O
Pb + PbO2 + 4 H+ +2SO42-
PbSO4 + 2 H2O
则下列说法正确的是 ( )
A.放电时,电流方向由B过M到A
B.充电时,铅蓄电池的正极应与充电器电源的负极相连
C.放电时,正极反应是 Pb - 2e - + SO42- ==== PbSO4
D.充电时,阳极反应是PbSO4 - 2e - +2 H2O ==== PbO2 + SO42- +4 H+
13.以下对化学实验的描述合理的是 ( )
A.实验室使用无水乙醇和浓硫酸以3:1的体积比混合加热制乙烯
B.中和滴定实验前,所使用的滴定管和锥形瓶必须洗净、干燥
C.用于检验气体的试纸必须先湿润
D.硫酸铜晶体里结晶水含量的测定实验中,盛晶体的坩埚灼烧后,需放在石棉网上冷却后称量
第Ⅱ卷
26.(15分)
![]() t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 ( g ) +O2 ( g
)
2 SO3 (g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 ( g ) +O2 ( g
)
2 SO3 (g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
(1)从反应开始至达到化学平衡,生成SO3平均反应速率为_____________;平衡时SO2转化率为__________________。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n molSO2的同时生成n mol O2
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是_________________
A.向容器中通人少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)t℃时,若将物质的量之比n(SO2):n(O2)= 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20 %。SO2的转化率为________。
27.(15分)
下图是一个制取氯气并以氯气为原料制取氯化铁的装置,请回答下列问题。
 |
(1)A是氯气发生装置,其中发生的反应的离子方程式为____________________
(2)实验开始时,先点燃装置A处的酒精灯,打开旋塞K、L,让Cl2 充满整个装置,再点燃装置D处的酒精灯,Cl2 通过C 瓶后再进入D装置的硬质玻璃管,D中发生反应的化学方程式为______________________________
(3)装置C的作用是__________________________________。如果没有装置C,而让气体直接进入D,则D中反应产物将可能含有杂质___________________(填化学式)
(4)D处反应完毕后,关闭旋塞K、L,移去酒精灯,由于余热的作用,装置A仍有Cl2产生,此时B中出现的现象是_______________________________;装置B的作用是
_______________________________________。
(5)实验开始后,E中溶液红色褪色,褪色的原因可能是:①溶液已变酸性,酚酞呈无色 ②酚酞被氧化褪色。请设计一个实验方案验证褪色的原因是①或②(简述实验操作、现象、结论)。
____________________________________________________________________________________________________________________________________________________
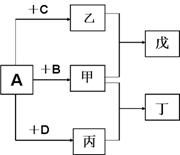 28.(15分)短周期元素a、b、c、d的原子序数依次增大,
28.(15分)短周期元素a、b、c、d的原子序数依次增大,
它们分属于不同主族,这四种元素的原子电子层数之和
为8。A、B、C、D依次是a、b、c、d的单质,在一定
条件下可以发生如图所示的化合反应:
甲、乙、丙分子内原子数依次为4、3、2。
(1)将甲和丙两气体混合后产生白烟,则丁的化
学式是___________,若将甲通入乙中所得
溶液pH 大于7,则乙的化学式是_______________。
(2)甲、乙、丙三分子中,电子数相同的是_____________(填化学式);甲与乙等物质的量化合而成戊,戊的化学式为_____________。
(3)高温时,甲与C在催化剂作用下加热可以发生反应。该反应是工业生产某强酸的重要
环节,此反应的化学方程式为________________________________________
(4)甲+D ——→丁+B,写出该反应的化学方程式______________________
(5)若甲溶液和溶液的pH之和等于14,两溶液等体积混合.所得溶液pH_______7(填“>”或“<”或“=”)。
(6)写出一种由a、b、c、d四种元素组成的化合物的化学式________________,该化合物构成的晶体是___________________晶体(填晶体类型)。
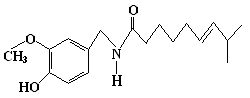
29.(15分)辣椒素又称为高纯辣椒碱,是辣椒中的主要辛辣成分。高纯辣椒碱因其具有许多特殊的生理活性而成为了药学研究的一个热点。现已被广泛用于治疗风湿性关节炎、跌打损伤、冻伤、戒毒、镇痛、止痒、杀菌消炎等种药物的生产。辣椒素的结构式为:
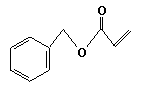
丙烯酸苯甲酯可表示为
( )
(1)辣椒素的分子式是_________________________________________
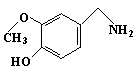
(2)1mol 辣椒素在一定条件下可以水解生成1 mol A和1 mol B ,A是:
( CH3 )2CHCH == CH ( CH2 )4COOH,则B的结构简式为______________
(3)A使溴的四氯化碳溶液褪色的化学方程式:_________________________________,反应类型是_____________。
B可溶于NaOH溶液,并消耗等物质的量的NaOH,反应的化学方程式:_ ___________________________________________________________
丙烯酸苯甲酯可以和A发生反应,生成丙烯酸CH2 == CHCOOH 和一种酯,反应的化学方程式;______________________________________________
理综卷(化学部分)答案
6、C 7、B 8、A 9、B 10、B 11、B 12、D 13、C
26、(15分)
(1)0.1 mol / L·min (3分) 20 %(3分)
(2)ABE(3分) (3)AD(3分) (4)80 % (3分)
|
|
(2)2 Fe + 3Cl2 ==== 2FeCl3 (3分)
(3)干燥氨气(1分);Fe2O3(2分,填Fe3O4也给分)
(4)瓶中液面下降,长颈漏斗中液面上升(1分);贮存少量多余的Cl2(1分,其他合理答案也给分)
(5)取少量E中已褪色的溶液,滴加浓NaOH溶液,若溶液变红说明褪色原因是①,否则是②(4分,其他合理答案也给分)
28、(15分)
(1)NH4Cl(1分) H2O(1分)
|
|
(4)8 NH3 + 3Cl2 === 6 NH4Cl + N2 (3分)
(5)>(2分)
(6)NH4ClO4(1分,或其他合理答案)离子晶体(1分)
 29、(15分)
29、(15分)
(1)C18H27O3N(2分,C18H27NO3也对) (2) (2分)
(3)(CH3)2CHCH == CH (CH2)4COOH + Br2 —→(CH3)2CHCHBrCHBr (CH2)4COOH (3分)加成反应(2分)
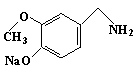
 (4)
(4)
+ NaOH ———→ + H2O
CH2 ==CHCOOCH2C6H5 + (CH3)2CHCH == CH (CH2)4COOH —→
(CH3)2CHCH == CH (CH2)4COOCH2C6H5 + CH2 == CHCOOH (3分)
