高考二模理综化学部分试题
5.生活中的问题常涉及到化学知识,下列叙述中不正确的是
A.用汽油、煤油除去油污时发生的主要是物理变化
B.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D.棉花、蚕丝和人造丝的主要成分是纤维素
6.下列叙述中,正确的是
A.二氧化硅和干冰晶体熔化时所克服的作用力类型相同
B.分子晶体中一定含有共价键,离子晶体中一定含有离子键
C.离子晶体都是强电解质
D.检验淀粉是否已经全部水解时、可取少量样品,向其中加入银氨溶液,水浴加热,若能生成银镜说明淀粉已经全部水解
7.有下列三个反应:①Cl2 + FeI2 = FeCl2 + I2 ②2Fe2+ + Br2 = 2Fe3+ + 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑+ 3H2O 下列说法正确的是
A.①②③中的氧化产物分别是I2 、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性Cl2 >Fe3+> Co2O3
C.根据反应①一定可以推理得到Cl2 + FeBr2 = FeCl2 +Br2
D.在反应③中当1molCo2O3 参加反应时,有2molHCl被氧化
8.一定能在下列无色溶液中大量共存的离子组是
A.c(H+)=1×10-13mol·L-1的溶液:Na+、Ba2+、HCO3-、SO42-
B.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
C.在能使紫色的石蕊试液变红的溶液中:Na+、NH4+、SO42—、Cl-
D.加入铝单质能产生大量氢气的溶液:Na+、NO3—、SO42-、Cl-
9.下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸②偏铝酸钠溶液与盐酸③苯酚钠溶液和CO2④硝酸银溶液和氨水⑤氯化铝溶液与氨水⑥碳酸氢钠溶液与澄清的石灰水
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
10.关于下列各装置图的叙述中,不正确的是( )
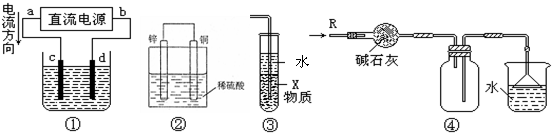
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液。
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
11.下列说法正确的是
A.只有非金属能形成含氧酸和含氧酸盐
B.ⅥA族元素的氢化物中稳定性最好的,其沸点也最高
C.同一主族的元素,原子半径越大其单质的熔点越高
D.除稀有气体外的非金属元素,都能形成不同价态的含氧酸
12.下列说法正确的是
A.若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB
B.相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是 c(Na+)>c(CH3COO—) >c(OH—) >c(H+)
D.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA‑)+c(A2-)+c(H2A)]
Ⅱ卷
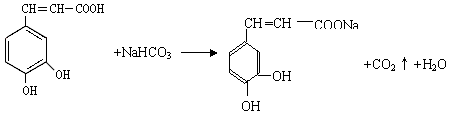
25.(16分)咖啡酸(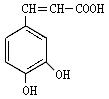 )也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
)也叫3,4-二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
(1)咖啡酸的分子式是
(2)咖啡酸不具有以下哪些性质
A.在浓硫酸、加热条件下能发生消去反应
B.能与FeCl3发生显色反应
C.能发生银镜反应
D.一定条件下能发生酯化反应
(3)1mol咖啡酸与浓溴水反应时最多消耗 mol Br2,反应类型有
(4)咖啡酸一定条件下发生加聚反应的方程式
咖啡酸与NaHCO3溶液反应的方程式
(5)写出符合下列条件的有机物A的结构简式
有机物A分子式为C9H10O2;A分子中含有一个甲基;A能发生水解反应;在溶液中1molA能与2molNaOH反应。
(6)将一定量咖啡酸与A的混合物点燃。该混合物完全燃烧消耗x L O2,并生成y g H2O和m L CO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸的物质的量的计算式 。
26.(18分)现有一份含有FeCl3和FeCl2固体混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4 g
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂 和
(3)实验2通入足量Cl2的目的是
涉及的化学反应的离子方程式是
(4)检验实验2的步骤④中沉淀已经洗涤干净的方法是:
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的特性。以下关于胶体的说法不正确的是
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能作布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为 。
(8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去)
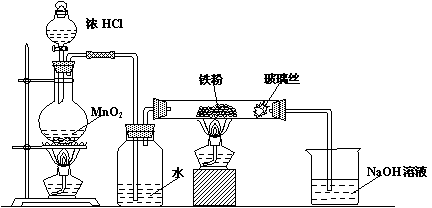

A B C D
该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施
27.(14 分)有A、B、C、D、E五种短周期元素,原子序数依次增大。A元素原子内无中子;B、C、D同周期;B元素原子最外层电子数是次外层的2倍;D是地壳中含量最多的元素;E与A同主族。回答下列问题:
(1)画出E的离子结构示意图
(2)D、E形成的一种化合物甲能与B、D形成一种化合物乙反应,生成D的单质。写出甲与乙反应的化学方程式
(3)采用石墨为电极,电解A、D、E三种元素所形成的一种化合物,其阳极电极反应为
(4)A、C能形成一种常见气体丙,其分子为 分子 (填“极性”或“非极性”;丙的电子式为 实验室制取气体丙的化学方程式为 ;
(5)在一定条件下,1mol气体丙还可与D的单质反应生成水蒸气和另一种气体,同时转移![]() 个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
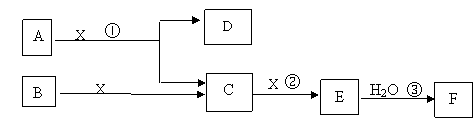 28.(12分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:
28.(12分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:
(1)A的化学式
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子 mol
(3)写出D与铝单质反应的化学方程式
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是
5、D 6、C 7、D 8、C 9、A 10、A 11、B 12、D
25、(16分)
(1)C9H8O4 (1分)
(2)A、C(2分,见错不得分)
(3)4 (2分) 加成反应和取代反应(2分 见错不得分)

(4)
n
(每个方程式2分,缺条件和↑扣1分)
(5) (2分)
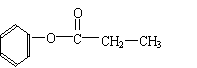

(6)
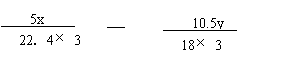
或
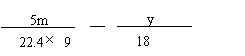
或
(3分)
26、(18分)
(1)烧杯、玻璃棒(2分,见错不给分)
(2)稀盐酸 铁粉(各1分)
(3)将Fe2+全部转化为 Fe3+ (2分) 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-(2分)
(4)向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净。(2分)
(5)FeCl3 在水中存在如下平衡 。 在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3 固体。
(方程式1分,文字说明1分)
(6)C E(2分,见错不得分)
(7)2:3(2分)
(8)在B、C之间和C、D之间分别增加盛有浓硫酸的洗气瓶防止FeCl3 潮解(2分,答全给分,答不全不给分)
27、(14分,每个2分,方程式无↑扣1分)
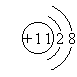 |
(1)
(2)2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
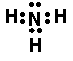 (3)4OH——4e—=2H2O+O2↑
(3)4OH——4e—=2H2O+O2↑
(4)极性
(5)4NH3(g) + 7O2(g) = 4NO2(g) + 6H2O(g) △H=-1131.2kJ/mol
28、(12分,每空2分)
(1)FeS2
(2)22mol
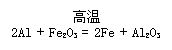
(3)
(缺条件扣1分)
(4)D、E(见错不得分)
(5)SO2 + 2Na2OH = 2NaHSO3
(6)2
