08届高考理综周练化学试题
可能用到的相对原则质量:
H—1 C—12 N—14 O—16 F—18 Mg—24 S—32 Zn—65
6. 据报道,科学家发现了一种新的氢微粒,它是由三个氢原子核和二个电子构成的。关于这种氢微粒的叙述正确的是………………………………………………………………………………………… ( )
A. 与氢气是同素异形体 B. 是一种新型化合物
C. 其中含有离子键 D. 能被还原成![]()
7. 能大量共存的离子组是…………………………………………………………………………………( )
A.HCO3-、NH4+、K+、Ca2+
B.Na+、ClO-、SO32-、SO42-
C.Mg2+、Fe3+ 、 Cl-、SCN-
D.AlO2-、K+、Al3+、NO3-
8. 下列氢化物不能由单质直接化合制取的是……………………………………………………………( )
A.H2S B. HI C.H2Se D. H2Te
9. 下列叙述正确的是……………………………………………………………………………………( )
A. 由于水分子间存在氢键,所以水很稳定
B. 能与酸反应生成盐和水的氧化物一定是碱性氧化物
C. 原子晶体中,共价键的键能越大,其熔、沸点越高
D. 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
10.
若![]() 表示阿伏加德罗常数的数值,以下说法中正确的是…………………………………………( )
表示阿伏加德罗常数的数值,以下说法中正确的是…………………………………………( )
A. 标况下,22.4L氟化氢中含2N个原子
B. 12g金刚石中有4N个C—C
C. 1L0.5mol/LNH4Cl溶液中含粒子总数约为N
D. 常温常压下,0.5mol氩气含0.5N个原子
11. 下列离子方程式书写正确的是:………………………………………………………………………( )
A. 向石灰乳中通入Cl2制漂白粉
Cl2 + 2OH- = Cl- + ClO- + H2O
B. 次氯酸钙溶液中通入过量的二氧化碳
![]()
C. 向100mL 0.1moL /L的溴化亚铁溶液中通入0.015 mol的氯气
![]()
D. 用铁做电极电解稀硫酸溶液的阳极电极式
![]() 4OH- — 4e- = 2H2O + O2
4OH- — 4e- = 2H2O + O2
12. 有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是……………………………………………………………( )
A.若HnXOm为强酸,则X的氢化物溶于水后一定显酸性
B.若X(OH)m为强碱,则Y(OH)n一定是强碱
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定是+m
13.将一定质量的锌与10ml18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成标准状况下的气体3.36L。将反应后的溶液稀释至100ml,测得溶液中C(H+)=0.1mol/L。则投入的锌的质量是………………( )
A.6.5g B. 9.75g C. 13g D. 15g
26.(14分)有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
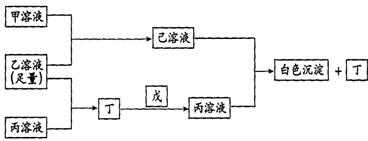
请回答:
(1)写出C元素的原子结构示意图__________,写出丁和戊的电子式__________、__________;
(2)用有关化学用语解释:乙溶液呈酸性的原因___________________;
丙溶液呈碱性的原因_____________________________;
(3)写出有关反应的离子方程式:
① 乙溶液+丙溶液→丁______________________________;
② 己溶液+丙溶液→丁______________________________。
27.(16分)已知,当羟基与双键碳原子相连接时,易发生如下转化:
化学式为C8H8O2的有机物有如下的转化关系:
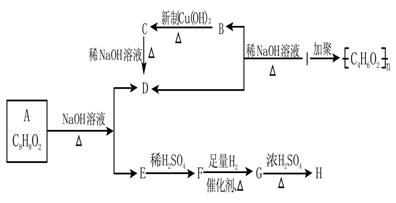 |
其中F能与FeCl3溶液显紫色。
回答:
(1)结构简式E B I
(2)写出反应类型
B→C G→H
(3)写出下列反应的化学方程式
①A→D+E 。
②B→C 。
(4)写出与A具有相同的官能团且含甲基的A的芳香族化合物的同分异构体的结构简式(不含A):
28.(18分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:
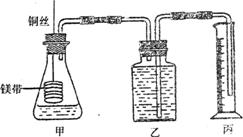 |
①配制浓度均为0.5mol/L H2SO4和H2C2O4溶液;
②用酸式滴定管量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带ag,并系于铜丝末端,a的数值至少为 ;
④检查装置的气密性,在广口瓶中装满水,按图连接好装置;
⑤将铜丝向下移动,使足量镁带浸人酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后,读取量筒内水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84g·cm-3,98%的浓H2SO4配制浓度为0.5mol/L的H2SO4溶液,所需要的仪器为 。
(2)用文字表述④检查装置气密性的操作与观察方法:
。
(3)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积。这三步操作的正确顺序是 。
(4)读取量筒内水的体积时,若丙中液面高于乙中液面,如何使乙、丙 中液面相平? 。
(5)本实验中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(6)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm= 。
(7)简述速率不等的原因 ,
铜丝不与酸接触的原因是 。
29.(12分)氨气和氟气在铜的催化作用下反应得到一种铵盐NH4F和一种含氮化合物A,A的分子结构呈三角锥形,分子中所有共价键之间的夹角都相等。
(1)A的化学式为__________,A的电子式为____________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目__________________________________。
(3)现有1mol混合气体充分反应后,测得生成物NH4F中的N元素比A中的N元素多2.8g,试计算原反应混合气中NH3和F2的物质的量可能各是__________________。
化学答题卷
26.(1) __________, __________、__________;
(2) ______________________________;
_____________________________;
(3)① 乙溶液+丙溶液→丁______________________________;
② 己溶液+丙溶液→丁______________________________。
27.(1) E B I
(2)B→C G→H (3)①A→D+E 。
②B→C 。
(4)
28.
(1) 。
(2)
(3) 。
(4) 。
(5)
(6)Vm= 。
(7) ,
。
29. (1) __________, ___________。
(2) ___________________________________。
(3) ___________________________________。
化学参考答案
6.D 7.A 8.D 9.C 10.D 11.C 12.B 13.B
 26.(14分)(1) ,
26.(14分)(1) , ![]() ::C:::
::C:::![]() , Na+[:
, Na+[:![]() :
:![]() :]2-Na+(每空2分)
:]2-Na+(每空2分)
(2) HSO4-=H++SO42-, CO32-+H2O![]() HCO3-+OH-分(3分)
HCO3-+OH-分(3分)
(3) ① 2H++CO32-= CO2↑+H2O;
② 2Al3++3CO32-+3H2O =2Al(OH)3↓+3CO2↑(每空2分)
28. ③0.12 (1分) ⑤反应起止时间 (1分)
(1)至(7)每空2分
(1)量筒,烧杯,玻璃棒,容量瓶,胶头滴管
(2)两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气
(3)②①③ (4)将量筒缓缓向下移动,使乙、丙中液面相平
(5)B (6)0.2VL/mol
(7)酸的浓度相同时c(H+)不同 ;防止形成原电池,干扰实验现象的观察
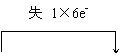 29.(12分)(1)NF3 (2分)
29.(12分)(1)NF3 (2分) ![]() (2分)
(2分)
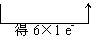 (2)
4NH3+3F2==3NH4F+NF3(4分)
(2)
4NH3+3F2==3NH4F+NF3(4分)
(3) F2 0.3mol, NH3 0.7mol;(2分)
NH3 0.4mol, F2 0.6mol。(2分)
