选择题训练(27)
一、选择题(每小题只有一个正确答案,每小题4分,共32分)
1、下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是
A、3%H2O2溶液 B、1mol/LHCl C、1mol/LKClO3溶液 D、1mol/LNaOH溶液
2、甲乙两种化合物都只含有X、Y两种元素,甲、乙中X元素的质量分数分别为30.4%和25.9%。若已知甲的分子式是XY2,则乙的分子式可能是
A、XY B、X2Y C、X2Y3 D、X2Y5
3、在反应X + 2Y = R + 2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为
A、16 :9 B、23 :9 C、32 :9 D、46 :9
4、下列有关气体体积的叙述中,正确的是
A、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定。
C、不同的气体,若体积不同,则它们所含的分子数也不同;
D、气体摩尔体积是指1摩尔任何气体所占的体积约为22.4L
5、在氧化还原反应3S + 6KOH = K2SO3 + 2K2S + 3H2O中,被氧化和被还原的硫原子数之比为
A、1 :2 B、2 :1 C、1 :1 D、3 :2
6、向50mL18mol/LH2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量(单位:mol)
A、< 0.45 B、0.45 C、在0.45和0.90之间 D、> 0.45
7、下列性质中,可以证明某化合物内一定存在离子键的是
A、可溶于水; B、具有较高的熔点; C、水溶液能导电; D、熔融状态能导电
8、元素Y的原子获得3个电子或元素X失去2个电子后,它们的电子层结构与氖原子的相同,X、Y两元素的单质在高温下得到的化合物的正确的化学式是
A、Y3X2 B、X2Y3 C、X3Y2 D、Y2X3
二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9、关于化学键的下列叙述中,正确的是
A、离子化合物中可能含共价键; B、共价化合物中可能含离子键
C、离子化合物中只含离子键; D、共价化合物中不可能含离子键。
![]()
![]()
![]()
![]()
![]()
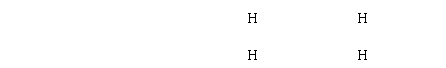 10、下列电子式书写正确的是
10、下列电子式书写正确的是
A、[Na+]: S :2-[Na+] B、H+[: S :]2-H+ C、H:N D、[H : N : H]+[ : Cl :]-
11、关于晶体的下列说法中正确的是
A、在晶体中只要有阴离子就一定有阳离子; B、在晶体中只要有阳离子就一定有阴离子;
C、原子晶体的熔点一定比金属晶体的高; D、分子晶体的熔点一定比金属晶体的低。
12、起固氮作用的化学反应是
A、N2和H2在一定条件下反应生成NH3; B、NO与O2反应生成NO2;
C、NH3经催化氧化生成NO; D、由NH3制碳酸氢铵和硫酸铵。
13、将铁屑溶于滴有KSCN溶液的过量盐酸后,再加入下列物质,溶液呈红色的是
A、硫酸 B、氯水 C、硝酸锌 D、氯化铜
14、由锌、铁、铝、镁四种金属中的两种组成的混合物10克,与足量的盐酸反应产生的氢气在标
况下的体积为11.2L,则混合物中一定含有的金属是
A、锌 B、铁 C、铝 D、镁
15、某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加过量盐酸,溶液中大量减少的阳离子是
A、NH4+ B、Mg2+ C、Fe2+ D、Al3+
16、76.8mg铜与适量浓硝酸反应,铜全部作用后,如果NO3-离子减少2×10-3mol,则溶液中H+离子同时减少
A、4.8×10-3mol B、4.4×10-3mol C、3.2×10-3mol D、2.2×10-3mol
17、按下述实验方法制备气体,合理而又实用的是
A、锌粒与稀硝酸反应制备H2; B、向饱和氯化钠溶液中滴加浓硫酸制备HCl;
C、亚硫酸钠与浓硫酸反应制备SO2; D、大理石与浓硫酸反应制备CO2。
18、短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是
A、原子半径A<B<C B、A的氢化物的稳定性大于C的氢化物;
C、B的氧化物熔点比A的氧化物高; D、A与C可形成离子化合物。
