08届高考化学元素周期律和元素周期表练习1
1.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是 ( )
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
2.已知短周期元素的离子aA2+、bB+、cC3-、dD-一都具有相同的电子层结构,则下列叙述正确的是
A.原子半径A>B>C>D B.原子序数a>b>c>d
C.离子半径C3->D一>B+>A2+ D.单质的还原性A>B>D>C
3.两种微粒的质子数和电子数均相等,下列关于两种微粒间关系的说法错误的是 ( )
A.它们可能是不同的分子 B.它们可能是不同的离子
C.它们可能互为同位素 D.它们可能是分子和离子
4.根据判断,下列各元素一定属于主族元素的是 ( )
A.X元素能形成+7价的含氧酸及其盐 B.Y元素的原子最外电子层上有2个电子
C.Z元素的阴离子与同一周期稀有气体元素原子的电子层结构相同
D.R元素的氧化物是两性氧化物
5.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A.D元素处于元素周期表中第3周期第IV族
B.四种元素的原子半径:A<B<D<C
C.B、D的最高价氧化物中,B、D与氧原子之间均为双键
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
6.下列指定微粒的个数比为2:1的是 ( )
A.Be2+离子中的质子和电子 B.21H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子 D.BaO2(过氧化钡)固体中的阴离子和阳离子
7.下列分子结构图中的大黑点表示原子序数小于10的元素的“原子实”(指原子除去最外层电子的剩余部分),小黑点表示没形成共价键的最外层电子,短线表示共价键。其中分子结构图与化学式关系错误的是( )
 A.
A.![]() (NH3)
B.
(NH3)
B.![]() (HCN)
(HCN)
C.![]() (C3H4O) D.
(C3H4O) D.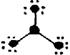 (BF3
(BF3
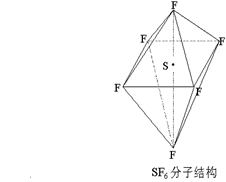
8.六氟化硫是一种无色气体,具有很强的稳定性,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应,SF6的分子结构如下图所示,呈正八面体型。下列有关SF6的推测正确的是。
A、SF6易燃烧生成二氧化硫 SF6是极性分
B、SF6中各原子均达到 8 电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF
D、如果F元素有两种稳定的同位素,则SF6的不同分子种数为10种
9.根据中学化学教材所附元素周期表判断,下列叙述不正确的是 ( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
10. (2007年高考广东化学卷)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
(A)X的氢化物溶于水显酸性 (B)Z的氢化物的水溶液在空气中存放不易变质
(C)X和Z的最高价氧化物对应的水化物都是弱酸 (D)Y的氧化物是离子化合物
二、填空题
11.A、B、C、D、E、F、G为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1— | 0 | 2+ | 1+ | 0 |
其中B的离子半径大于E的离子半径;D是由极性键构成的4个原子的极性分子,C与F可形成两个共价型G分子。
⑴A微粒的质子结构示意图是 。
⑵B与E的最高价氧化物对应水化物的碱性强弱为 > (用化学式表示)。
⑶D溶于水的电离方程式为 。
⑷G微粒所构成的晶体类型属于 。
⑸C微粒是 ,F微粒是 。(用化学式表示)
12.(13分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有
原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;
D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、
B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号);
A.比较这两种元素的气态氢化物的沸点 B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素的单质与氢气化合的难易
(2)写出C、D两元素形成的原子个数比为1:1的化合物与E、C两元素形成的原子个数比为1:2的化合物反应的化学方程式: 。
(3)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
.
(4)A与C和E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)B元素的气态氢化物和其一种常见氧化物(双原子分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为 。
(6)在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A44和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
12.(1)氧(1分) CD(1分)
(2)Na2O2+SO2 Na2SO4,(2分)
(3)HSO3—+H+ SO2↑+H2O;(2分)
(4)HS—+OH— S2—+H2O(2分)
(5)2:3(2分)
(6)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-641.5kJ·mol—1(3分)