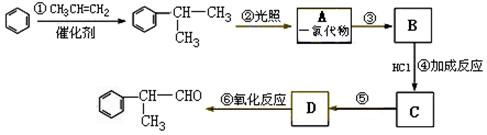
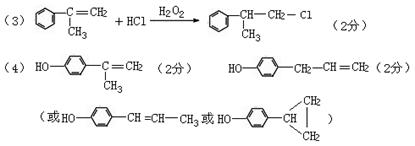
08届高考化学六校联考模拟试卷(三)
化学试题
本卷可能用到的相对原子质量:
H:1;C:12;O:16;Na:23;Mg:24;Al:27;Si:28;Fe:56
 一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本大题8小题,每题3分,共24分)。
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本大题8小题,每题3分,共24分)。
1.节能减排与我们的生活息息相关,参与节能减排是每一位公民应
尽的义务。下列举措不符合这一要求的是
A.自2008年6月1日起,实行塑料购物袋有偿使用。
B.房屋装修中尽量增加钢材、铝型材和木材使用量。
C.进一步推广使用乙醇汽油作为汽车的燃料。
D.洗涤衣物时合理使用无磷洗衣粉等洗涤剂。
2、下列说法或做法中正确的是
A.氟氯烃的大量排放是造成酸雨的主要原因
B.等质量的同种煤粉和煤块完全燃烧,放出热量前者大于后者
C.液氯泄漏事故发生时,周边的人应该朝顺风方向逃逸或向避风的沟塘低洼处转移
D.火箭发动机有偏二甲肼(C2H8N2)与N2O4混合后充分燃烧,可生成CO2、N2和H2O
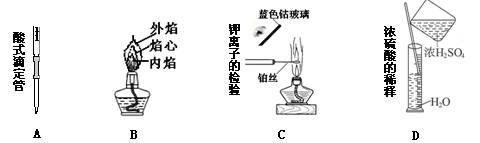
3.下列关于实验仪器名称的标注或实验操作正确的是
4.城市环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源,d处在下游有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的
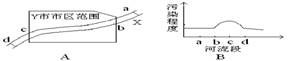
A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物等可能是造成X河污染的污染源
C.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理。
D.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
5.下列情况下,可以大量共存的离子组是
A. 使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
B. 由水电离的c(H+) = 1×10-14 mol·L-1的溶液中:Ba2+、K+、Cl-、HCO3-
C. 与铝反应放出大量氢气的溶液中:NH4+、SO42-、CO32-、Na+
D. 在c(H+)/ c(OH-)=1012的溶液中:NH4+ 、Al3+、Ca2+、Cl-
6. 已知白磷(P4)与CuSO4溶液反应的化学方程式为:11P4+60CuSO4+96H2O == 20Cu3P+24H3PO4+60H2SO4,则1molCuSO4能氧化白磷的物质的量是 ( )
A.2/5mol B.1/5mol C.11/5mol D.1/20mol
7.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有
关说法中,不正确的是
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.NH5固体投入少量水中,可产生两种气体
D.1molNH5中含有5 mol N-H键
8.将氨水滴加到盛有AgC1的试管中,AgC1逐渐溶解,对上述过程,下列叙述或解释正确( )
A.所得溶液中c(Ag+)×c(C1-)<KSP(AgC1)B.所得溶液中形成了更难电离的物质
C.上述实验说明C1与NH4+间有很强的结合力 D.上述过程中NH3·H2O的电离程度增大
二、不定项选择题:在每题的四个选项中,有一个或两个选项符合题意。若正确答案只包括
一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选
两个且都正确的得满分,但只要选错一个该小题就为0分(本大题包括6小题,每题4分,
共24分)。
9. 下列反应方程式书写正确的是
A. 硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O = AgOH↓+ NH4+
B. 钢铁发生吸氧腐蚀的正极反应:4OH--4e- = 2H2O + O 2↑
C. 20mL0.1mol/LAlCl3溶液中加入70mL0.1 mol·L-1NaOH溶液:2Al3++7OH- = Al(OH)3↓+AlO2-+2H2O
D. 向Ba(OH)2稀溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3•H2O+H2O
10.镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法不正确的是
A.电池总反应为:Mg+H2O2=Mg(OH)2
B.正极发生的电极反应为:H2O2+2H++2e-=2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+向负极移动
11.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A. 25℃时,1 L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子
B.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移约0.2×6.02×1023个电子
C.1 mol羟基(-OH)所含的电子数约为10×6.02×1023
D.标准状况下,测得一定量的铜与硝酸反应后生成22.4 L的混合气体 ,则被还原的硝酸的分子数应大于6.02×1023
12.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,正确的是
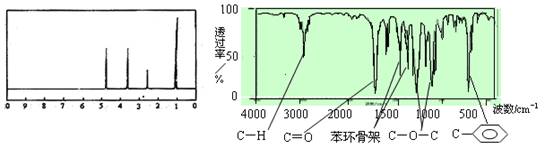
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与4 mol H2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
13.下列溶液中各微粒的浓度关系不正确的是
A.0.1mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)==c(H+)
B.1L0.lmol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
14、向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.21mol C.0.16 mol D.0.14 mol
三、(本题包括2小题,共12分)
15.(1)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
16、铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
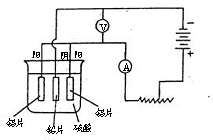 b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
试回答下列问题
①用苯和酒精擦拭铝片的目的: ,氢氧化钠溶液处理铝片的目的是: 。
②下列有关说法正确的是 (填序号)。
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al +6H+ ![]() 2Al3+
+3H2↑
2Al3+
+3H2↑
③阴极的电极反应式为: 。
四、(本题包括2小题,共18分)
17.(8分)工业生产硝酸铵的流程图如下:
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________________(任写一条)
(2)已知N2(g)+3H2(g)![]() 2NH3(g),ΔH=-92 kJ·mol-1。请回答:
2NH3(g),ΔH=-92 kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是_________________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式。_______________________________________________________________________
该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(增大、减小、无影响),其原因是_____________________________________。
(4)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为_______________。
18.(10分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己、庚七种物质之间的相互反应关系如图:
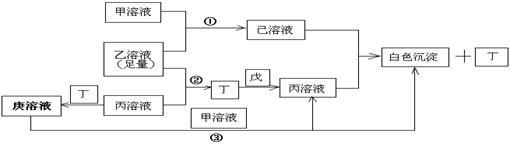
(1)画出C元素核外电子排布式____________,戊的电子式_____ ______。
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________ __________;
丙溶液呈碱性的原因_________ ___________;
(3)写出有关反应①②③的离子方程式:
① ;
② ;
③ 。
五、(本题包括1小题,共10分)
19.(10分)某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
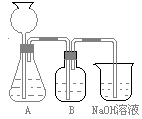 b.小火煮沸溶液1~2 min;
b.小火煮沸溶液1~2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式 ____________________、____________________________。
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检查整个装置的气密性________________________________________。
(3)装置B中盛放的试剂是______________,作用是_______________________________。
(4)在实验室通常制法中,装置A还可作为下列_____________气体的发生装置(填序号)。
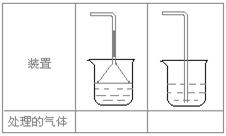 ①CH2==CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
①CH2==CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4, ⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶 液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________。
六、(本题包括1小题,共12分)
20.(12分)有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1) (X为卤素原子)
(X为卤素原子)
|
工业上利用上述信息,按下列路线合成结构简式为
的物质,该物质是一种香料。
|
请根据上述路线,回答下列问题:
(1)A的结构简式可能为 和 。
(2)反应①、③、⑤的反应类型分别为
、 、 。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件)
。
(4)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
。
七、(本题包括1小题,共8分)
21.(8分)为研究水滑石的组成、结构和性质,某校研究性学习小组取得了二种牌号的水滑石样品拟进行探究,请你参与探究并回答相关问题。
 (1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
(1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
当温度在0~280℃质量不变,是什么原因: 。
A→B减少的物质及其物质的量为: ;
C→D减少的物质及其物质的量为: ;
D处化学组成为: 。
(2)乙组取的CA(美国化学文摘)登记号为12304-65-3 的合成水滑石样品,现只知其化学式为:MgaAlb(OH)C(CO3)d, a+b+c+d=25, a、b、c、d为正整数。取该水滑石样品0.1mol,用1mol/L盐酸使其完全溶解。
①消耗盐酸的体积至少为: L(用字母表示);
②若参加反应的盐酸的物质的量与生成CO2的物质的量之比为18∶1,则该水滑石的化学式为: 。
 八、(本题共12分。)
八、(本题共12分。)
22.(物质结构与性质,12分)
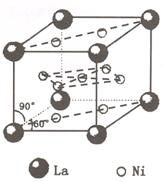
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(![]() ) 和镍(
) 和镍(![]() ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
![文本框: I、镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。 +3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。
II、在Ni2+的溶液中加入强碱时,会生成 Ni(OH)2沉淀,在强碱性条件下,该沉淀可以被较强的氧化剂 (如 NaClO) 氧化为黑色的难溶性物质 NiO(OH) 。
III、镍易形成配合物如 Ni(CO)6、[Ni(NH3)6] 2+ 等。](http://shijuan.zww.cn/attachimg/tkgzhx/08jiegao181/image035.gif) ①写出 Ni3+ 的核外电子排布式:
①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
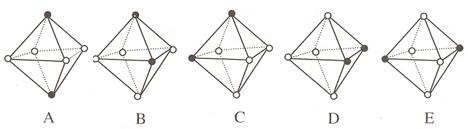
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
高三六校联考模拟试卷答题纸
第Ⅰ卷(选择题,共48分)
一、二选择题(1—8题为单项选择题;9—16题为1-2个正确答案的选择题)
|
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共12分)
15.(1) 。
(2)① ,② .
③ 。
16.(10分)(1) 。
(2)① , ;② 。
(3)
。
四、(本题包括2小题,共18分)
17.(1) ; 。
(2)①
②
(3)① ;
② ;
③ 。
18.(1) , ,
, 。
(2) 。
(3) 。
(4) 。
(5) 。
五、(本题包括1小题,共10分)
19.(1) 。
(2) 。
(3) , 。
(4)
(5)
。
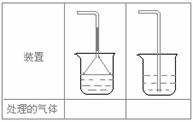
(6) 。
六、(本题包括1小题,共12分)
20.(8分)(1)A: , 。
(2) , , 。
(3) 。
21.(1) ; ;
; 。
(2)① ②
七、(8分。)
22.(12分)(1) 。
(2)
(3)① ② ,
(4) ,
八、(12分。)
1) 。
(2) ( 填序号 )
(3)①
②
(4) 。
高三六校联考模拟试卷(三)
化学试题参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其它合理答案的也给分。
一、共24分。每小题3分。每小题只有一个选项符合题意。
1.B 2.C 3.C 4.C 5.D 6.D 7.D 8.D
二、共24分。每小题4分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。
9.CD 10.AD 11.BD 12.A 13.CD 14.B
三、(本题包括2小题,共12分)
15、答案:(1)ABCD
16、(共8分,每空均2分)
①除去表面的油污;除去表面自然形成的氧化膜;②A; ③6H++6e-=3H2↑。
四、(本题包括2小题,共18分)
17、(共8分)(1)可做氮肥等;
(2)①<,在1atm和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为500℃,所以放出的热量小于92.4kJ; ②CEF(答2个且正确者得0.5分;全对得1分;多1个错误答案扣0.5分,扣完为止)。
(3)4NH3+5O2![]() 4NO+6H2O, K=
4NO+6H2O, K=![]() , 减小。
, 减小。
因为氨的催化氧化反应是放热反应,所以升高温度,K会减小。
(4)30% (2分)
18、(1)略 ![]()
(2)NaHSO4=Na++H++SO42-、NaHSO4在水溶液中完全电离出氢离子使溶液呈酸性
![]() CO32-+H2O HCO3+-OH-、CO32-水解使溶液呈碱性
CO32-+H2O HCO3+-OH-、CO32-水解使溶液呈碱性
(3)AlO2-+4H+=Al3++2H2O 2H++CO32-=H2O+CO2↑;
HCO3-+ AlO2- + H2O = CO32-+ Al(OH)3↓
五、(本题包括1小题,共10分)
19、(1) 2NaOH + CO2 == NaHCO3 (1分) NaHCO3 + NaOH == Na2CO3 + H2O (1分)
(2)方法①:用弹簧夹夹住A、B连接处,先检查A的气密性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气。然后检查B的气密性:向烧杯中注入少量水,使导管口侵入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气。
方法②:也可一次检查A、B的气密性:连接和烧杯间的乳胶管用止水夹夹住。然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气。 (3) 饱和酸氢钠溶液 吸收HCl气体
(4) ②④⑤ (5) ①③ ②④ (6) 7.2 mol/L
六、(本题包括1小题,共12分)
|
|
七、(本题包括1小题,共8分)
21.(共12分,每空均2分)(1)天然水滑石在温度低于280℃是稳定的;0.4molH2O;0.1molCO2;6MgO·Al2O3;(2)①0.1c+0.2d或0.2a+0.3b;②Mg6Al2(OH)16CO3
八、(12分。)
22、(1)LaNi5
+ 3H2 ![]() LaNi5H6;(3分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
LaNi5H6;(3分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
(2)CE (2分,每选对一个给一分,每错选一个倒扣一分,扣完本小题分为止)
(3)①[Ar]3d7;或![]() (2分,写成3d7不给分)
(2分,写成3d7不给分)
②2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(3分,未配平不给分,氯气未写气体符号扣一分)
(4)A和B(或A和C、A和D、B和E、C和E、D和E任一组均可);(2分,若同组中出现同种物质则不给分,例如AE、BC……等)