08届高考化学分子结构巩固练习2
1.下列关于粒子结构的描述不正确的是 ( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
2.下列物质的熔、沸点高低顺序中,正确的是 ( )
A.金刚石 >晶体硅 >二氧化硅 >碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>O2>N2>H2O D.金刚石>生铁>纯铁>钠
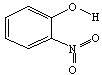
3.已知各种硝基苯酚的性质如下表
| 名称 | 结构式 | 水中溶解度/g (25℃) | 熔点/℃ | 沸点/℃ |
| 邻—硝基苯酚 |
| 0.2 | 45 | 100 |
| 间—硝基苯酚 |
| 1.4 | 96 | 194 |
| 对—硝基苯酚 |
| 1.7 | 114 | 295 |
下列关于各种硝基苯酚的叙述不正确的是 ( )
A.邻—硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚
B.间—硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对—硝基苯酚分子间能形成氢键,使其熔沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
4.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A 、 X与Y形成化合物是,X可以显负价,Y显正价
B 、第一电离能可能Y小于X
C 、 最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D 、气态氢化物的稳定性:HmY小于HmX
5.在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
6.下列说法正确的是: ( )
A.126g P4含有的P-P键的个数为6NA B.12g石墨中含有的C-C键的个数为2NA
C.12g金刚石中含有的C-C键的个数为1.5NA D.60gSiO2中含Si-O键的个数为2NA
7.下列关于主族元素的说法正确的是
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.主族元素的最高正价等于主族的序数 D.主族元素的价电子数有可能超过最外层电子数
8.氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
(1)写出(CN)2与苛性钠溶液反应的离子方程式_______________________________;
(2)已知氰分子中键与键之间的夹角为180°,并有对称性,
则(CN)2的电子式为____________,结构式为____________________________,
分子空间构型为_______________,是__________分子(填“极性”或“非极性”);
(3)氰分子中碳原子为__________杂化;一个氰分子中包含_________个σ键,_______个π键。
9.根据下列要求,各用电子式表示一实例:
(1)只含有极性键并有一对孤对电子的分子
(2)只含有离子键、极性共价键的物质
(3)只含有极性共价键、常温下为液态的非极性分子
10.(1)利用VSEPR推断分子或离子的空间构型
PO43-______________ ;CS2_______________ ;AlBr3(共价分子)_______________ 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
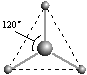 ________________;
________________; ___________________。
___________________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子____________,四面体形分子_____________。
11.(10分)氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式
。
⑵NH2-的电子式为 。 ⑶N3-有 个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式 。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
8.(1)(CN)2+2OH-══CN-+CNO-+H2O
(2)![]() ,N≡C—C≡N,直线型、非极性
,N≡C—C≡N,直线型、非极性
(3)sp,3、4
9.(1)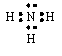 ;(2)
;(2)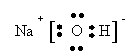 ;(3)
;(3)![]()
10.⑴四面体形 直线形 平面形 ⑵CH3+ CH3- ⑶BF3 NF3 CF4
11.(9分)
⑴N2H62++2OH-=N2H4+2H2O(2分)
⑵![]() (2分)
(2分)
⑶22 (1分)
⑷N2O CO2 CNO- BeF2 CaH2 C3H4等 (两空各1分)
[说明]可将N3-中“N-”换为O得到N2O,还可进行类似变换得到其他等电子体。
⑸直线型(1分)
⑹一个单位正电荷 (1分)