高考化学复习第二次月考试题
化学试题
命题人:孙文儒
命题范围:物质结构, 元素周期律, 晶体的类型与性质; 氧族元素,
硫酸工业, 环境保护; 碳族元素,硅酸盐工业。
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分.
满分共100分,考试时间90分钟.
可能用到的原子量:H一1 N一14
第Ⅰ卷(选择题)
一.选择题(本题包括20小题,每小题2分,共40分,每小题只有一个选项符合题意)
1、下列物质有固定的熔点,且熔点逐渐降低的一组物质是( )
A.HI、HBr、HCl、HF B.石英、食盐、干冰、钾
C.重油、柴油、煤油、汽油 D. KI、I2、Hg、O2
2、下列化学用语表达正确的是( )![]()
![]() A.S2-的结构示意图:
B.乙炔的结构简式CHCH
A.S2-的结构示意图:
B.乙炔的结构简式CHCH
![]() C.NaCl的电子式: D.硝基苯的结构简式:
C.NaCl的电子式: D.硝基苯的结构简式:
3、将木炭与浓硫酸共热后得到的气体通入下述溶液中,不会得到无色澄清溶液的是( )
A.品红溶液 B.饱和H2S溶液
C.BaCl2溶液 D.溴水
4、下列化学反应中,由于反应物的用量不同而得到不同产物的是( )
①H2S+O2;②P+Cl2;③P2O5+H2O;④NaCl(固)+H2SO4(浓);⑤AlCl3+NaOH;⑥乙醇和浓硫酸;⑦SO2+H2S;⑧碳酸钠和稀盐酸;⑨硫和氧气;⑩H2S+NaOH
A.全部都是 B.①②⑤⑧⑩
C.①②⑤⑦⑧⑩ D.①②④⑤⑦⑧⑨⑩
5、青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为:Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉可能是一种硅酸盐
B.青石棉中含有一定量的石英晶体
C.1mol青石棉能和18molHNO3反应
D.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
6、由下列各组的三种元素构成的化合物中,既有离子晶体,又有分子晶体的是
A、H、O、C B、Na、S、O C、H、N、O D、H、S、O
7、通过复习总结,你认为下列对化学知识概括合理的是( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
8、科学家预言,C3N4晶体很可能具有比金刚石还大的硬度,且每个原子最外层均满足8电子稳定结构。则下列关于C3N4晶体的说法正确的是:( )
A.C3N4 晶体可能是分子晶体,晶体微粒间通过共价键结合
B.C3N4晶体中C—N键长比金刚石中C—C要长
C.C3N4 晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4 晶体中N的最外层电子均参与成键
9、下列说法中正确的是 ( )
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C. 金属离子和自由电子间通过金属键形成的晶体是金属晶体
D.CO2与SiO2都是分子晶体,所以它们有接近的熔、沸点
10、据最新报道,清华才女朱令11年前离奇的铊中毒案,再次引起人们关注。铊盐与氰化钾被列为A级危险品。铊(Tl)的原子序数为81,Tl3+与Ag在酸性条件介质中发生反应:Tl3++2Ag=Tl++2Ag+,Ag++Fe2+=Ag+Fe3+.下列推断不正确的是( )
A.Tl+最外层有2个电子 B.氧化性:Tl3+>Fe3+>Ag+>Fe2+>Al3+
C.还原性:Tl>Fe>Ag D.铊位于第六周期,第IIIA族
11、根据等电子原理:由短周期元素组成的微粒,其原子数相同,且各原子最外层电子数之和也相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是( )
A、CO和N2 B、O3和SO2 C、N2H4和C2H4 D、CO2和N2O
12、科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现A1的超原子结构A113和A114,并在质谱仪检测到稳定的Al13I-等。A113、A114的性质很象现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是( )
A、All4与ⅡA族元素性质相似
B、A113与卤素性质类似
C、A113在气相中与HI反应的方程式可表示为:A113+HI=HAl13I
D、A113超原子中A1原子间是通过离子键结合的
13、触法生产H2SO4过程,对废气、废水、废渣、“废热”的处理正确的是:( )
①尾气用氨水处理;②污水用石灰乳处理;③废渣用来造水泥,炼铁;④设置“废热”锅炉产生蒸气,供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
14、研究表明:H2O2具有立体结构,两个氢原子像在半展开一本书的两页上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法错误的是( )
A.H2O2分子中既有极性键又有非极性键
B.H2O2分子为含有非极性键的极性分子
C.H2O2分子为非极性分子
D.H2O2分子为既含极性键又含非极性键的极性分子
15、下列属于新型无机非金属材料特性的是( )
①能承受高温,强度高;②具有电学特性;③具有光学特性;④具有生物特性;⑤可塑性好。
A.① B.①② C.①②③⑤ D.①②③④
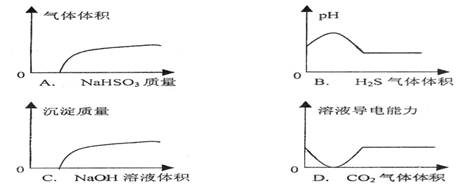
|
A.NaHSO3粉末加入HNO3溶液中 B.H2S气体通入氯水中
C.NaOH溶液滴入Ba(HCO3)2中 D.CO2气体通入澄清石灰水中
17、锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中Ge元素处于最高价态,铋元素的价态与它跟氯形成某些共价化合物所呈的价态相同,且此氯化物中铋具有8电子稳定结构,可表示为![]() .则式中x等于 ( )
.则式中x等于 ( )
A.2z-4y B.![]() C.
C.![]() D.
D.![]()
18、FeS2的结构类似于![]() ,是一种过硫化物,与酸反应时生成
,是一种过硫化物,与酸反应时生成![]() ,
,![]() 类似
类似![]() 易分解.实验室用稀盐酸与
易分解.实验室用稀盐酸与![]() 颗粒混合,则反应完毕后,不可能生成的物质是( )
颗粒混合,则反应完毕后,不可能生成的物质是( )
A.![]() B.S C.FeS D.
B.S C.FeS D.![]()
19、下列叙述正确的是( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
20.在某无色溶液中,加入BaCl2溶液有白色沉淀,再加稀硝酸,沉淀不消失,则下列判断正确的是( )
A.一定有SO42- B.一定有CO32- C.一定有Ag+ D.可能有SO42-或SO32-或Ag+
第Ⅱ卷(非选择题 共60分)
二、填空题(本题包括6小题,共47分)
21.(3分)请写出6个分子式,使每个分子中都含有18个电子。
______、_______、______、_______、______、_______。
22.(3分)同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
⑴已知酸性FCH2COOH>CH3COOH,试推断:①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)_________________。
⑵已知AgCl可溶于稀氨水形成银氨溶液、AgBr可溶于浓氨水形成银氨溶液、AgI不溶于浓氨水,它们都不溶于水。试推断:上述三种银盐在水中溶解度由大到小的顺序____________。
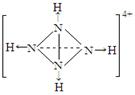
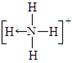 (3)已知P4、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为:
(3)已知P4、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为:
(→表示共用电子对由N原子单方面提供)。
请画出N4H44+的结构式_____________________。
23.(13分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。
五种元素两两形成的化合物有甲、乙、两、丁四种,分子中原子个数比如下表:
|
| 甲 | 乙 | 丙 | 丁 |
| 化合物中各元 素原子个比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
回答下列问题:
(1)写出元素符号:B E ;
D、E的原子半径大小是__________。
(2)A元素某原子核内中子数比质子数多1,则该核素的核组成符号为 。
(3)丁分子的空间构型为 。 丁的分子为 分子(填“极性”或“非极性”)。
(4)甲分子的电子式为 ;向甲的水溶液中加入MnO2,氧化产物是 。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为 。
(6)已知:乙分子中所有原子共平面,则实验室制取乙的化学方程式为 。
(7)丙的水溶液加热蒸干再灼烧,最后所得固体的成分是 (写化学式)
24、(10分)某核素R具有微弱放射性,其原子核内中子数比质子数多43。由R组成的固体单质A,在一定条件下密度为6.88g/cm3。用x射线研究固体A表明,在边长为1.00×10-7cm的立方体中含有20个原子。R在化学反应中常表现为+2、+4价。在溶液中R2+稳定,而R4+有强氧化性。
请回答:
(1)R原子的摩尔质量为_________________________;
(2)R元素位于周期表的第_______周期_________族,名称为________;
(3)将SO2通入到黑色的RO2悬浊液中有白色沉淀生成,此反应的方程为:
;
(4)在Mn2+的溶液中加入HNO3无明显变化,再加入RO2,溶液变紫红色;如果将HNO3改为盐酸,则不显紫红色。写出有关反应的离子方程式:
___________________________________________________________,
___________________________________________________________。
25.(7分)

⑴ 在上面元素周期表中全部是金属元素的区域为___________。
(a)A (b)B (c)C (d)D
⑵ 有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是______________。
⑶ 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是______________(填名称), 可以验证该结论的实验是_____________________________。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
26、(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
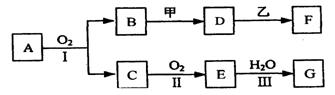
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则:
①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近, 有大量白烟生成。则:
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。
③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
三、实验题(本大题包括1小题,共13分)
27.(13分)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图7-4所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)。
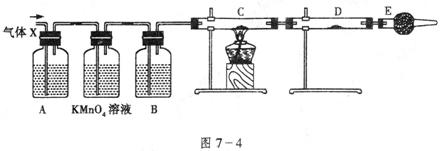
试回答:
(1)上述反应中生成二氧化硫的化学方程式为:____________________。
(2)乙同学认为还可能产生氢气的理由是:_________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是:______________。
(4)A中加入的试剂可能是____________,作用是_______________;
B中加入的试剂可能是____________,作用是_______________;
E中加入的试剂可能是____________,作用是_______________。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_________________,D中:__________________;
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____________(填“能”或“不能”)。原因是:___________________。
化学试题
答题卷
班 姓名 考号
第Ⅰ卷(选择题,共60分)
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题 共60分)
二、填空题(本题包括6小题,共47分)
21.(3分)______、_______、______、_______、______、_______。
22.(3分)⑴_________________。⑵溶解度由大到小的顺序 。
(3)N4H44+的结构式_____________________。
23.(10分)(1)元素符号:B: E: ;D、E的原子半径大小是__________。
(2)该核素的核组成符号为 。
(3)丁分子的空间构型为 。 丁的分子为 分子
(4)甲分子的电子式为 ;氧化产物是 。
(5)有关离子方程式为 。
(6)实验室制取乙的化学方程式为 。
(7)最后所得固体的成分是 (写化学式)
24、(7分)(1)R原子的摩尔质量为_________________________;
(2)R元素位于周期表的第_______周期_________族,名称为________;
(3)此反应的方程式为: ;
(4)有关反应的离子方程式:___________________________________________________________,
___________________________________________________________。
 25.(7分)⑴全部是金属元素的区域为___________。
25.(7分)⑴全部是金属元素的区域为___________。
⑵这一元素是______________。
⑶① 用元素符号将甲、乙两元素填写在上面元素
周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是
______________(填名称),
可以验证该结论的实验是 。
26、(11分)(1)①工业上反应I在 中进行,反应Ⅲ在 中进行。
②反应条件是 或 。
③反应I的化学方程式是 。
(2)①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。
③该反应的热化学方程式:
三、实验题(本大题包括1小题,共13分)
27.(13分)(1)生成二氧化硫的化学方程式为: 。
(2)可能产生氢气的理由是: 。
(3)必不可少的一步操作是: 。
(4)A中加入的试剂可能是 ,作用是 ;
B中加入的试剂可能是 ,作用是 ;
E中加入的试剂可能是 ,作用是 。
(5)含有氢气的实验现象是:C中:_________________,D中:__________________;
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____________(填“能”或“不能”)。原因是: 。
平昌县第二中学高2007级高考复习第二次月考
化学试题
参考答案
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | D | B | B | B | C | D | C | C | B |
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | D | D | C | D | D | B | C | C | D |
二、填空题(本题包括6小题,共47分)
 21、(各0.5分,共3分)Ar、F2、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6、CH3OH、CH3NH2(任选6种)
21、(各0.5分,共3分)Ar、F2、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6、CH3OH、CH3NH2(任选6种)
22、(3分)⑴③②① ⑵AgCl>AgBr >AgI ⑶
(各1分,共3分)
23、(13分)(1)B: C E:Cl Al > Cl (各1分,共3分)
(2)![]() ; (1分)
; (1分)
(3)正四面体(写四面体不计分);非极性 (各1分,共2分)
(4)H O O H ;O2 (各1分,共2分)
(5)Al3++3HCO3—=Al(OH)3↓+3CO2↑ (2分)
(6)CH3CH2OH![]() CH2=CH2↑+H2O (2分)
CH2=CH2↑+H2O (2分)
(未写反应条件及未注明温度或温度错误等均不计分)
(7)Al2O3 (未写化学式不计分)(1分)
24、(10分) (1).207g/mol; (2分)
(2).六 ⅣA 铅; (各1分,共3分)
(3)PbO2 + SO2 = PbSO4 (1分)
(4)5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4- +2H2O (2分)
PbO2 + 4H+ + 2Cl- = Pb2+ +Cl2↑ + 2H2O (2分)
25、⑴ b ⑵ H ⑶ ① (Mg、Al) ② 镁 b、c(每空1分,共7分)
26、(11分)、(1)①沸腾炉 吸收塔(每空1分,共2分)
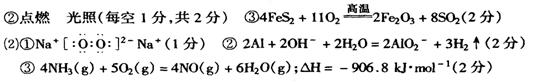
三、实验题(本大题包括1小题,共13分)
29、((每空1分,共13分))
(1)![]()
(2)当Zn与浓![]() 反应时,浓
反应时,浓![]() 浓度逐渐变稀,Zn与稀
浓度逐渐变稀,Zn与稀![]() 反应可产生
反应可产生![]()
(3)检查装置的气密性
(4)品红溶液; 检验![]() ;
;
浓![]() ; 吸收水蒸气;
; 吸收水蒸气;
碱石灰; 防上空气中水蒸气进入D中
(5)C中黑色(![]() )变成红色
)变成红色![]() ;D中白色粉末变成蓝色;不能;因为混合气体中可能含
;D中白色粉末变成蓝色;不能;因为混合气体中可能含![]() ,会干扰
,会干扰![]() 的检验(其它合理答案也给分)
的检验(其它合理答案也给分)