高三化学专题练习︰选择题(一)
1.下列说法正确的是( )
A.淀粉和纤维素均可以有(C6H10O5)n表示,因此它们互为同分异构体
B.17g羟基中所含电子的物质的量为9mol
C.铁位于元素周期表中第四周期第ⅧB族
D.氨、塑料和橡胶都是以石油化工为基础的三大合成材料
2.设NA为阿佛加德罗常数的值,下列有关叙述不正确的是( )
A.常温常压下,NA个CH4分子的体积大于22.4L
B.lmol·L-1的醋酸钠溶液中含CH3COOH、CH3COO-共NA个
C.足量Na2O2和常温常压下22 g CO2反应,转移电子数目为0.5NA
D.含1mol碳原子的金刚石中,C-C共价键数为2NA个
3.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水(无晶体析出),得到的溶液的密度为q g/mL,物质的量浓度为c mol/L,则溶质的相对分子质量为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
4.下列离子方程式正确的是( )
A.Na2S溶液水解:S2-+H2O=HS-+OH-
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.向酸性氯化亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O
D.铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
 5.分析右面的能量变化示意图,下列热化学方程式正确的是( )
5.分析右面的能量变化示意图,下列热化学方程式正确的是( )
A.2A(g)+B(g)=2C(g);△H=a(a>0)
B.2A(g)+B(g)=2C(g);△H=a(a<0)
C.2A+B=2C;△H=a(a<0)
D.2C=2A+B;△H=a(a>0)
6.航天器的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化放热引发高氯酸铵反应,其反应式为:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑。反应放出大量热,下列对该反应的叙述中,错误的是( )
A.NH4ClO4既是氧化剂,又是还原剂
B.反应中只有Cl元素被还原
C.1mol NH4ClO4完全反应时,转移14 mol电子
D.从能量角度看,化学能主要转变为热能和动能
7.2004年批量生产的笔记本电脑用的是甲醇燃料电池。甲醇在催化作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与O2反应,电池总反应式为:
2CH3OH+3O2→2CO2+4H2O。下列说法正确的是( )
A.正极通入的物质是甲醇
B.负极通入的物质是空气
C.负极反应式为CH3OH+H2O-6e-→CO2+6H+
D.正极反应式为O2+2H2O+4e-→4OH-
8.在一定容积的密闭容器中,加入2L X(g)和3L Y(g),发生如下反应:
nX(g)+3Y(g)![]() 2R(g);ΔH=-Q
kJ/mol,平衡后,测得X和Y的转化率分别为:a%和b%,已知a<b,则n值为( )
2R(g);ΔH=-Q
kJ/mol,平衡后,测得X和Y的转化率分别为:a%和b%,已知a<b,则n值为( )
A.1 B.2 C.3 D.4
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(二)
1.环境污染已成为人类面临的重大威胁,下列对应关系不正确的是( )
| 环境问题 | 造成环境问题的主要物质 | |
| A | 酸雨 | 二氧化硫 |
| B | 温室效应 | 二氧化碳 |
| C | 白色污染 | 二氧化硅 |
| D | 光化学烟雾 | 二氧化氮 |
2.已知:天然气的主要成分是甲烷,汽油的主要成分之一是辛烷,它们的燃烧热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.3 kJ/mol
C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l);ΔH=-5518 kJ/mol
下列说法正确的是( )
A.完全燃烧相同物质的量的甲烷和辛烷放出的热量,前者大于后者
B.完全燃烧相同质量的甲烷和辛烷放出的热量,前者大于后者
C.完全燃烧标准状况下相同体积的甲烷和辛烷放出的热量,前者大于后者
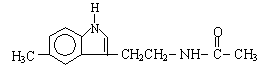 D.燃烧汽油比燃烧天然气污染小
D.燃烧汽油比燃烧天然气污染小
3.脑白金主要成分的结构简式为:
下列对脑白金主要成分的推论不正确的是( )
A.其官能团和营养成分与葡萄糖相同
B.其分子式为C13H16N2O
C.该物质能与溴水反应
D.该物质能发生水解反应并生成乙酸
4.X溶液滴入Y溶液和Y溶液滴入X溶液现象不同的是( )
| A | B | C | D | |
| X溶液 | MgCl2溶液 | MgCl2溶液 | AlCl3溶液 | AlCl3溶液 |
| Y溶液 | NaOH溶液 | 氨水 | NaOH溶液 | 氨水 |
5.关于过氧化钠与水反应的实验,下列说法不正确的是( )
A.产生的气体能使带火星的木条复燃
B.向包裹Na2O2固体的棉花上滴水,棉花燃烧,说明反应强烈放热
C.向有Na2O2固体的试管中加水,所得溶液中加入酚酞试液后,溶液先变红后褪色
D.反应中水是还原剂
6.关于高分子材料,下列说法不正确的是( )
A.有机玻璃(聚甲基丙烯酸甲酯)为线性结构,可溶于适当的溶剂(如氯仿)
B.橡胶为体型结构,不能溶于一般溶剂
C.聚乙烯为热塑性塑料,受热变软,熔化
D.酚醛树脂为热固性塑料,受热变软,熔化
7.在FeCl3与KSCN混合后的血红色溶液中,加入适量NaF晶体后,得到一种无色溶液,据此推知( )
A.F- 将Fe3+ 还原为Fe2+ B.NaF溶于水后具有漂白性
C.F- 与Fe3+ 结合成沉淀物 D.F- 与Fe3+ 结合成更难电离的可溶于水的物质
8.对反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);ΔH<0。下列有关叙述正确的是( )
4NO(g)+6H2O(g);ΔH<0。下列有关叙述正确的是( )
A.化学反应速率关系是2v(NH3)=3v(H2O)
B.其它条件不变,降低温度,NO的体积分数将增大
C.若单位时间内生成a mol NO,同时消耗a mol NH3,则反应达到平衡状态
D.其它条件不变,增大容器容积,则正反应速率减少,逆反应速率增大
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(三)
1.在硫酸的工业制法中,下列生产操作及说明生产操作的主要原因二者都正确的是( )
A.从沸腾炉出来的炉气须净化,因为炉气中SO2会与杂质发生反应
B.硫铁矿燃烧前需要粉碎,否则块状的硫铁矿石不能燃烧
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
D.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
2.在实验中不慎手被玻璃划破,可用FeCl3溶液应急止血,其主要原因是( )
A.FeCl3溶液具有杀菌消毒作用 B.FeCl3溶液能使血液凝聚
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 D.FeCl3能使血液发生化学作用
3.下列离子方程式正确的是( )
A.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.常温时偏铝酸钠溶液pH>7:AlO2-+2H2O=Al(OH)3↓+OH-
C.等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2=2Fe3++I2+4Br-
D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
4.现有浓度均为1mol·L-1的FeCl3、CuCl2、FeCl2的混合溶液100mL,向该溶液中加入5.6g铁粉,待反应完毕。下列有关叙述不正确的是( )
A.反应后的溶液中含有Fe2+、Cu2+,不含Fe3+
B.反应后的溶液中含有Fe2+ 0.2mol、Cu2+ 0.1mol
C.反应后的溶液中Fe2+ 增至0.3mol
D.反应后容器中残留有Cu 0.05mol
5.下列有关实验中,用所选用的试剂(括号内物质)不能达到目的的是( )
A.检验Na2SO4溶液中是否混有NaCl(AgNO3溶液)
B.证明FeCl2溶液被氧化(KSCN溶液)
C.除去C2H2气体中的H2S气体(CuSO4溶液)
D.鉴别SO2和CO2两种气体(溴水)
6.一定温度下,在2L密闭容器中加入4.0mol A和6.0molB,发生如下可逆反应:
2A(g)+3B(g)![]() 4C(g)+D(g)。反应10min后达到平衡,此时D的浓度为0.5mol·L-1。
4C(g)+D(g)。反应10min后达到平衡,此时D的浓度为0.5mol·L-1。
下列说法正确的是( )
A.前10min反应的平均速率v(C)=0.1mol/(L·min)
B.反应达到平衡时B的平衡浓度是1.5mol·L-1
C.恒温下,将反应容器体积压缩为原来的一半,则D的平衡浓度小于1.0mol·L-1
D.10min后在容器中加入A,重新建立平衡时A的转化率一定大于50%
7.已知1.2 g C(石墨)不完全燃烧生成CO,放出11.1 kJ热量,继续燃烧又放出28.3 kJ热量。则能表示C(石墨)燃烧热的热化学方程式为( )
A.C(石墨 s)+1/2O2(g)=CO(g);△H=-11.1kJ·mol-1
B.C(石墨 s)+1/2O2(g)=CO(g);△H=-111kJ·mol-1
C.C(石墨 s)+O2(g)=CO2(g);△H=-394kJ·mol-1
D.C(石墨 s)+O2(g)=CO2(g);△H=-283kJ·mol-1
8.用铁作阴极,石墨作阳极电解含Mg2+、Ca2+、SO42-杂质的饱和食盐水,通电一段时间后,发现某电极附近食盐水变浑浊,对造成浑浊的原因叙述正确的是( )
A.由于H+放电,故生成Mg(OH)2 B.由于Cl-放电,故生成Mg(OH)2
C.由于铁溶解生成Fe(OH)2 D.由于H+放电,故生成Ca(OH)2
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(四)
1.下列说法正确的是( )
A.红热的铜丝在氯气中燃烧,生成蓝色固体CuCl2
B.浓硝酸应保存在无色细口瓶中
C.酸碱中和滴定操作中,锥形瓶不需干燥
D.苯和甲苯均能使酸性高锰酸钾溶液褪色
2.pH=1的两种一元酸HX和HY溶液,分别取50mL加入足量的镁粉,充分反应后,收集到H2体积分别为VHX和VHY。若VHX>VHY,则下列说法正确的是( )
A.HX可能是强酸 B.HY一定是强酸
C.HX的酸性强于HY的酸性 D.反应开始时二者生成H2的速率相等
3.NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol氦气含有2NA个核外电子
B.常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换出22.4LH2
C.标准状况下,0.5NA个CCl4所占的体积约为11.2L
D.42g NaHCO3固体含有的离子数为1.5NA
4.下列化学用语书写正确的是( )
A.碳酸钡溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑
![]() B.用石墨电极电解硝酸银溶液:4Ag++2H2O 4Ag+O2↑+4H+
B.用石墨电极电解硝酸银溶液:4Ag++2H2O 4Ag+O2↑+4H+
C.硫氢化钠水解:HS-+H2O![]() H3O++S2-
H3O++S2-
D.明矾溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
5.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡,测得平衡时A、B、C物质的量之比为n(A)︰n(B)︰n(C)=1︰1︰2,若保持温度不变,以1︰1︰2的物质的量之比再充入A、B、和C,下列判断中正确的是( )
2C(g)达到平衡,测得平衡时A、B、C物质的量之比为n(A)︰n(B)︰n(C)=1︰1︰2,若保持温度不变,以1︰1︰2的物质的量之比再充入A、B、和C,下列判断中正确的是( )
A.平衡不移动
B.平衡向逆反应方向移动
C.新平衡时各物质的浓度都比原平衡时增大
D.C的质量分数减小
![]() 6.某种只含铁和氧两元素的样品A.在高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,得沉淀的质量是原样品A质量的 倍,由此得出的结论,其中正确的是( )
6.某种只含铁和氧两元素的样品A.在高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,得沉淀的质量是原样品A质量的 倍,由此得出的结论,其中正确的是( )
①A可能是Fe2O3; ②A可能是Fe3O4
③A一定是纯净物 ④A可能是混合物
A.①② B.②③ C.②④ D.①③
7.能分别将含有Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH4+、Na+等离子的七种溶液一次性鉴别开来的试剂是( )
A.NaHCO3 溶液 B.NaOH溶液
C.KSCN溶液 D.NH3·H2O
8.已知2KClO3+I2=2KIO3+Cl2,下列对此反应的说法正确的是( )
A.氧化产物与还原产物的物质的量比为1︰2
B.若在标准状况下产生11.2 LCl2,转移电子的物质的量为1mol
C.I2的还原性强于Cl2
D.Cl2和I2都是氧化剂
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(五)
1.下列物质的使用不会对环境造成污染的是( )
A.含磷洗衣粉 B.氢气
C.含汞电池 D.煤
2.中和一定量的某醋酸,当溶液pH=7时,消耗氢氧化钠m g。如果先向该醋酸的溶液中加入少量醋酸钠,然后再氢氧化钠中和此醋酸,当溶液pH=7时,此时可消耗氢氧化钠n g。则m和n的大小关系是( )
A.m>n B.m<n
C.m=n D.无法确定
3.设NA代表阿伏加德罗常数,以下说法中正确的是( )
A.18克重水含有电子数为10NA
B.1molCl2与足量烧碱反应时共转移2NA个电子
C.1mol十七烷分子中的共价键总数为52NA
D.常温常压,活泼金属跟稀硫酸反应生成1mol H2,转移电子数为NA
4.下列反应的离子方程式书写正确的是( )
A.用氨水吸收少量SO2气体:2NH3·H2O+SO2=2NH![]() +SO
+SO![]() +H2O
+H2O
|
C.NH4HCO3溶液与过量的NaOH溶液共热:NH![]() +OH-=== NH3↑+H2O
+OH-=== NH3↑+H2O
D.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
5.某温度下反应H2(g)+I2(g)![]() 2HI(g);△H<0,在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
2HI(g);△H<0,在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温压缩体积,平衡不移动,但颜色加深
B.恒压充入He(g),平衡不移动
C.恒容,升温正反应速率减小
D.恒容充入H2,I2的百分含量降低
6.把Fe和Fe2O3组成的某混合物放入250mL2.0mol·L-1的HNO3溶液中,充分反应后,生成的NO气体在标准状况下的体积为1.12L,再向反应后的溶液中加入1.0mol·L-1的NaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液的体积最少是( )
A.400mL B.450mL
C.500mL D.550mL
7.下列各组物质不能用一种试剂通过化学反应区别的是( )
A.MnO2、CuO、FeO B.(NH4)2SO4、K2SO4、NH4Cl
C.AgNO3、KNO3、Na2CO3 D.Na2CO3、NaHCO3、K2CO3
 8.右图中,两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是( )
8.右图中,两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是( )
A.该装置可能是电解池
B.a 极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(六)
1.在下列各物质中加入过量盐酸后,最终不产生沉淀或混浊的是( )
A.偏铝酸钠溶液 B.苯酚钠溶液
C.硅酸钠溶液 D.硫代硫酸钠溶液
2.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++CO32-=CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓ 次要:Cu2++CO32-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质溶解度大小比较中,正确的是( )
A.Cu(OH)2>CuCO3>CuS B.CuS>CuCO3>Cu(OH)2
C.CuS>Cu(OH)2>CuCO3 D.CuCO3>Cu(OH)2>CuS
3.NA为阿佛加德罗常数,下列说法正确的是( )
A.lmolD2O所含质子数为12NA
B.在标准状况下,22.4LSO3所含分子数为NA
C.23gNa在空气中加热条件下,O2得到的电子数为2NA
D.3.4 g H2S气体完全燃烧需要O2的分子数为0.15NA
4.下列离子方程式正确的是( )
A.Fe(OH)3溶于过量的氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
|
C.铁作电极电解饱和食盐水:2Cl-+2H2O====2OH-+H2↑+Cl2↑
D.向过量苏打溶液中逐滴加入少量稀硫酸:CO32-+H+=HCO3-
5.一定条件下,向一带活塞的密闭容器中充入2mol SO2和lmol O2,发生下列反应:
2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入lmolSO3(g)
B.保持温度和容器内压强不变,充入lmolSO3(g)
C.保持温度和容器内压强不变,充入lmolO2(g)
D.保持温度和容器内压强不变,充入lmolAr(g)
6.在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01 molCl2,有一半Br- 变为Br2,原溶液中HBr和H2SO3的浓度都等于( )
A.0.0075 mol·![]() B.0.008 mol·
B.0.008 mol·![]()
C.0.075 mol·![]() D.0.08 mol·
D.0.08 mol·![]()
7.A、B、C三种短周期元素,原子序数按A、B、C依次增大,A元素原子最外层电子数是次外层电子数的2倍,B元素原子的次外层电子数是最外层电子数的2倍,C元素原子的最外层电子数是内层电子总数的一半。则下列说法中正确的是( )
A.A元素的气态氢化物都是含极性键的非极性分子
B.B元素在自然界的含量最多
C.C元素可以组成不同的单质,它们互为同素异形体
D.A、B、C的氧化物都能溶于水形成酸
8.已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素);
BrCl+H2O=HCl+HBrO,以下推论不正确的是( )
A.BrCl具有和卤素单质相似的化学性质
B.BrCl和M反应时,BrCl只作氧化剂
C.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐
D.将BrCl跟FeSO4溶液反应,溶液会变成无色
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(七)
1.据报道,德国INTEGRAL公司研究出无辐射冷却技术(用水和冰组成的物质代替传统的氟里昂或氨)而荣获德国环境大奖。关于这一“新致冷剂”,以下叙述不正确的是( )
A.该致冷剂对环境不产生任何污染
B.该致冷剂的作用原理与氨基本相同
C.该致冷剂在水的凝固点附近的温度下发挥作用
D.该致冷剂具有与水不同的化学性质
2.在一定的温度下,向CH3COONa的稀溶液里再加水稀释,下列各种量的变化中,变大的是( )
①c(H+) ②c(OH-) ③n(CH3COO-) ④c(H+)·c(OH-) ⑤n(CH3COOH)
A.②④ B.①③ C.③④ D.①⑤
3.设NA表示阿佛加德罗常数值,下列说法正确的是( )
A.500mL0.1mol·L-1的Al2(SO4)3溶液中,含Al3+ 0.1NA
B.36g重氧(18O2)气体所含分子数为NA,占体积为22.4L
C.7.8gNa2O2与足量CO2反应,转移电子数为0.1NA
D.15g甲基中含有的电子数为8NA
4.常温下,下列情况中,离子间一定能大量共存于同一溶液中的是( )
A.使甲基橙呈黄色的溶液中:I-、Cl-、NO![]() 、Na+
、Na+
B.使石蕊呈紫色的溶液中:NH![]() 、Al3+、NO
、Al3+、NO![]() 、HCO
、HCO![]()
C.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO![]() 、Na+
、Na+
D.含有Al3+的溶液中:K+、Mg2+、Na+、ClO-
5.一定条件下,建立平衡2NO2(g)![]() N2O4(g),以下说法正确的是( )
N2O4(g),以下说法正确的是( )
A.恒温恒容,再充入NO2,达到新平衡时,NO2的体积分数增大
B.恒温恒容,再充入N2,达到新平衡时,容器内颜色变浅
C.恒温恒压,再充入N2O4,达到新平衡时,混合气体的平均相对分子质量增大
D.恒温恒压,再充入Ar,达到新平衡时,NO2的转化率降低
6.氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解液为30%的KOH溶液,下列有关叙述正确的是( )
①负极反应为4OH—-4e=O2↑+2H2O ②负极反应H2+2OH—-2e=2H2O
③工作时正极区pH升高,负极区pH降低 ④工作时溶液中阴离子移向正极
A.③④ B.②③ C.②④ D.①④
7.在相同条件下,有下列三个热化学方程式:
(1)H2(g)+1/2O2(g)=H2O(g);△H=-Q1
(2)2H2(g)+O2(g)=2H2O(1);△H=-Q2
(3)2H2(g)+O2(g)=2H2O(g);△H=-Q3
则Q1、Q2、Q3的关系正确的是( )
A.Q1=Q3<Q2 B.Q2>Q3>Q1
C.Q3>Q2>Q1 D.Q1=Q2=Q3
8.ClSO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是( )
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值不变 D.反应后溶液的pH值增大
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(八)
1.下列分离或提纯物质的方法错误的是( )
A.用渗析的方法除去淀粉中的Cl-
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用盐析后过滤的方法从油脂皂化混合物中分离出肥皂
D.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
2.下列关于电解质溶液中离子关系的说法中正确的是( )
A.0.1mol·L-1Na2CO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合液溶中:
c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存
3.最近科学家们制出了首批氧一l8气体,18O是氧的一种稳定的核素,称为重氧。下列说法中正确的是( )
A.1.8g18O2气体的物质的量为0.1mol
B.0.1mol重氧水(H218O)中所含的中子数约为6.02×1023个
C.0.2mol18O2气体的体积约为4.48L
D.18O2气体的摩尔质量为36g
4.下列离子方程式书写正确的是( )
A.等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2++2OH–+2NH4++HCO3–=BaCO3↓+2NH3·H2O+H2O
B.氯化铝溶液中加入过量的氨水
Al3++4NH3·H2O=4NH4++AlO2–+2H2O
C.向次氯酸钙溶液中通入过量的二氧化硫
Ca2++2ClO–+SO2+H2O=CaSO3↓+2HClO
D.碳酸钠溶液中加入过量的苯酚
5.一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1︰c2=1︰3 B.平衡时,Y和Z的生成速率之比为3︰2
C.X、Y的转化率不相等 D.c1的取值范围为0<c1<0.14mol/L
6.在实验室进行物质制备,下列从原样及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
![]()
![]()
![]() A.C
CO
CO2
Na2CO3
A.C
CO
CO2
Na2CO3
![]()
![]() B.Cu
Cu(NO3)2溶液
Cu(OH)2
B.Cu
Cu(NO3)2溶液
Cu(OH)2
![]()
![]() C.Fe
Fe2O3
Fe2(SO4)3溶液
C.Fe
Fe2O3
Fe2(SO4)3溶液
![]()
![]() D.CaO Ca(OH)2溶液
NaOH溶液
D.CaO Ca(OH)2溶液
NaOH溶液
7.下列物质性质变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔沸点逐渐升高
8.某同学使用直流电源,在烧杯里电解饱和食盐水,电极用铁钉和碳棒。该同学错误地将铁钉接在电源正极,碳棒接负极.此情况下接通电源,观察到的现象可能是( )
A.阳极和阴极上都产生了气泡
B.阳极处产生了气泡,此气泡使湿润的碘化钾淀粉试纸变蓝
C.溶液出现了灰绿色浑浊,后逐渐变成了红褐色
D.阴极处未产生气泡,滴入酚酞试剂后变红
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(九)
1.NA表示阿佛加德罗常数的值,下列说法不正确的是( )
A.1L1mol/L的FeCl3溶液中,含有的Fe3+数目为1NA
B.标况下,22.4LCO含有的电子总数为14NA
C.0.5molNa2O2中含有的质子总数为19NA
D.常温常压下,活泼金属跟稀H2SO4反应生成1molH2,转移的电子数为2NA
2.下列叙述正确的是( )
![]() A.CO2的电子式为
A.CO2的电子式为
B.所有的主族元素的简单离子的化合价与其族序数相等
C.NH4Cl晶体中,既含有离子键,又含有共价键
D.下列物质均为极性分子:H2O、NH3、CCl4
3.将下列各种物质混合配制成溶液,向其中加入稀H2SO4,溶液一定不会变浑浊的是( )
A.BaCl2和NaHCO3 B.AlCl3和NaOH
C.Mg(NO3)2和KBr D.Na2SO3和Na2S
4.下列各组离子能大量共存的是( )
A.NH4+、Na+、CO![]() 、OH-
B.ClO-、S2-、K+、Fe3+
、OH-
B.ClO-、S2-、K+、Fe3+
C.Al3+、NO![]() 、AlO
、AlO![]() 、SO
、SO![]() D.H+、Ba2+、Cl-、NO
D.H+、Ba2+、Cl-、NO![]()
5.对于密闭容器中进行的反应,CO(g)+H2O(g)![]() CO2(g)+H2(g),△H<0,改变下列条件,平衡一定正向移动的是( )
CO2(g)+H2(g),△H<0,改变下列条件,平衡一定正向移动的是( )
A.增大压强 B.通入CO2
C.降温 D.加入催化剂
6.下列各项中的两个量,其比例为2︰1的是( )
A.40℃时,pH=7的(NH4)2SO4与NH3·H2O的混合液中,c(NH4+)与c(SO![]() )
)
B.相同温度下,0.02mol/L的醋酸溶液与0.01mol/L醋酸溶液中的c(H+)
C.液面均在“0”刻度时,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积
D.碳酸钠晶体中n(Na+)与n(CO32-)
7.下列离子方程式中正确的是( )
A.氯化铁溶液与铁反应:Fe3++Fe=Fe2+
B.硫酸铜溶液中通入硫化氢:Cu2++H2S=CuS↓+2H+
C.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO![]() +4NH4++2H2O
+4NH4++2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO![]() +OH-=CO2↑+H2O
+OH-=CO2↑+H2O
8.在一定温度下碳酸钠的溶解度为40g,向280g的饱和碳酸钠溶液中加入10.6g无水碳酸钠,搅拌静置,最终所得晶体(Na2CO3•10H2O)的质量为( )
A.10.6g B.60.6g
C.28.6g D.89.2g
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
高三化学专题练习︰选择题(十)
1.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:
HC≡C-C≡C-C≡C-C≡C-C≡N,对该物质判断正确的是( )
A.不能发生加成反应
B.晶体的硬度与金刚石相当
C.能使酸性高锰酸钾溶液褪色
D.可由乙炔和含氮化合物加聚制得
2.以NA代表阿伏加德罗常数,则对下列热化学方程式
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(1);△H=-1300 kJ/mol的说法正确的是( )
A.有10 NA个电子转移时,吸收1300 kJ的能量
B.有NA个C≡C三键断裂时,放出1300 kJ的能量
C.有NA个二氧化碳分子生成时,放出1300 kJ的能量
D.有NA个水分子生成时,吸收1300 kJ的能量
3.据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述不正确的是( )
A.该物质不具有很高的熔点、很大的硬度
B.该物质形成的晶体属分子晶体
C.该物质分子中Si60被包裹在C60里面
D.该物质的相对分子质量为2400
4.下列离子方程式书写正确的是( )
![]() A.NaClO溶液中加入盐酸:ClO-+H+ HClO
A.NaClO溶液中加入盐酸:ClO-+H+ HClO
B.BaSO3固体放入稀硝酸中:BaSO3+2H+=Ba2++SO2↑+H2O
C.饱和碳酸氢钠溶液中加入醋酸:CH3COOH+HCO3-=CH3COO-+CO2↑+H2O
D.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H++Ca2+=CH2O+2H2O+2CO2↑
5.在化学分析中,草酸(H2C2O4)是重要的还原剂,已知20.0mL 0.100 mol·L-1 VO2+离子恰好将20.0 mL 0.050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被还原为VOn+离子,则VOn+中的n值为( )
A.1 B.2 C.3 D.4
6.pH=11的X、Y两种碱溶液各l0 mL,分别稀释至1000 mL,其pH与溶液体积(V)的关系如下图所示,下列说法正确的是( )
 A.X、Y两种碱的物质的量浓度一定相等
A.X、Y两种碱的物质的量浓度一定相等
B.稀释后,X溶液中c(OH-)比Y溶液中c(OH-)大
C.若9<a<11,则X、Y都是弱碱
D.完全中和X,Y两溶液时,消耗同浓度盐酸的体积VX>VY
7.常温下,某溶液中由水电离产生的c(OH-)、c(H+)满足c(OH-)·c(H+)=10-26,下列各组离子在溶液中一定能大量共存的是( )
A.Fe2+、NO3-、Al3+、Cl- B.Mg2+、SO42-、Na+、HCO3-
C.Ba2+、NO3-、K+、Cl- D.K+、NH4+、AlO2-、CO3-
![]()
 8.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
8.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应过
D.升高温度,平衡会向正反应方向移动
请将答案填入下表
班级 姓名 学号
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
(一)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | B | D | C | B | C | C | A |
(二)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | B | A | C | D | D | D | B |
(三)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | B | D | B | A | B | C | A |
(四)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | D | A | B | C | C | B | C |
(五)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | A | C | A | C | B | D | D |
(六)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| A | D | D | D | B | B | C | D |
(七)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | D | C | C | D | B | B | B |
(八)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | C | B | D | C | D | D | C |
(九)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| A | C | C | D | C | D | B | D |
(十)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | B | C | C | B | C | C | B |