化学反应速率、化学平衡图像
一、ν-t图像或c-t图像
1. ν-t图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。
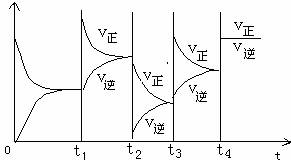 【练习1】对于反应2SO2(g)+O2(g)
【练习1】对于反应2SO2(g)+O2(g)
![]() 2SO3(g) △H<0, 填写改变的条件及平衡移动的方向。
2SO3(g) △H<0, 填写改变的条件及平衡移动的方向。
t1时, ,
平衡向 移动。
t2时, ,
平衡向 移动。
t3时, ,
平衡向 移动。
t4时, ,
平衡向 移动。
小结:改变 条件,图像一点保持连续;改变 ,两点突变,_____________使正逆反应速率同等程度的增大而平衡不移动。
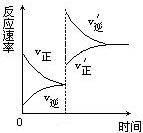 【练习2】对达到平衡状态的可逆反应X+Y
【练习2】对达到平衡状态的可逆反应X+Y![]() Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
 【练习3】在密闭容器,一定条件下进行反应,
【练习3】在密闭容器,一定条件下进行反应,
mA(g)+nB(g) ![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
A.正反应是吸热反应 B.逆反应是吸热反应
C.m+n>p+q D.m+n<p+q
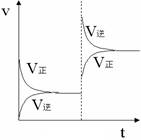
 【练习4】应N2(g)+3H2(g)
【练习4】应N2(g)+3H2(g)
![]() 2NH3(g) △H<0
在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( ) ,氨的百分含量最高的时间段是( )
2NH3(g) △H<0
在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( ) ,氨的百分含量最高的时间段是( )
A.t0-t1 B.t2-t3
C.t3-t4 D. t5-t6
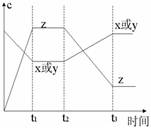 2. c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程式中各物质的化学计量数之比。
2. c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程式中各物质的化学计量数之比。
【练习5】今有X(g)+Y(g)
![]() 2Z(g) △H<0。从反应
2Z(g) △H<0。从反应
开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是( )
A.增大X或Y的浓度 B.增大压强
C.增大Z的浓度 D.升高温度
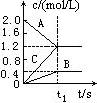 【练习6】右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。试回答:
【练习6】右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。试回答:
(1)该反应的反应物是______;
(2)反应物的转化率是______;
(3)该反应的化学方程式为___________________________。
二、平衡图像
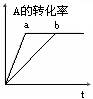 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
【练习7】已知某可逆反应在密闭容器中进行:
A(g)+2B(g) ![]() 3C(g)+D(s) △H<0,图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是(
)
3C(g)+D(s) △H<0,图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是(
)
A.增大A的浓度 B.缩小容器的容积
 C.加入催化剂
D.升高温度
C.加入催化剂
D.升高温度
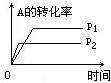
【练习8】现有可逆反应A(g)+2B(g) ![]() nC(g) △H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如右图,其中结论正确的是( )
nC(g) △H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如右图,其中结论正确的是( )
 A.p1>p2,n>3 B.p1<p2,n>3
A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
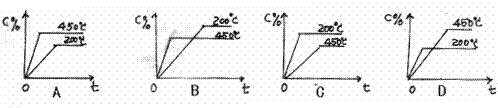
【练习9】对于可逆反应A(g)+B(g)![]() C(g) △H<0,下列图像正确的是( )
C(g) △H<0,下列图像正确的是( )
【练习10】可逆反应:aA(g)+
bB(g)![]() cC(g)+ dD(g)
cC(g)+ dD(g)
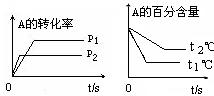 根据图回答:
根据图回答:
①压强 P1比P2 (填大或小) ;
②(a +b)比(c +d) (填大或小);
③温度t1℃比t2℃ (填高或低);
④正反应 热(填吸或放)。
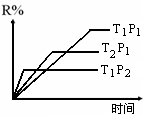 【练习11】在密闭容器中进行下列反应:
【练习11】在密闭容器中进行下列反应:
M(g)
+ N(g) ![]() R(g)
+ 2L,此反应符合右图,下列叙述正确的是( )
R(g)
+ 2L,此反应符合右图,下列叙述正确的是( )
A.正反应吸热 ,L是气体
B.正反应吸热, L是固体
C.正反应放热 ,L是气体
D.正反应放热 ,L是固体或液体
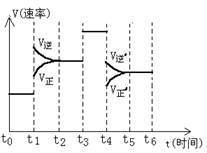
【练习12】等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气的总体积(V)与时间的关系正确的是( )
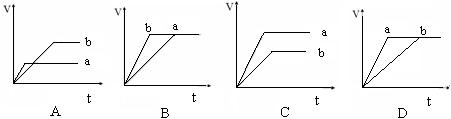
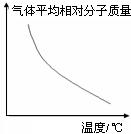 2.受两个变量(P、T)影响的图像:分析依据“定一议二”。转化率或百分含量等因素受到压强、温度两个变量的影响,先确定一个变量,分析另外两个量的关系。如确定温度分析转化率受压强的影响。
2.受两个变量(P、T)影响的图像:分析依据“定一议二”。转化率或百分含量等因素受到压强、温度两个变量的影响,先确定一个变量,分析另外两个量的关系。如确定温度分析转化率受压强的影响。
【练习13】可逆反应2A+B![]() 2C(g) △H<0,随温度变化气体平均相对分子质量如图所示,则下列叙述正确的是( )
2C(g) △H<0,随温度变化气体平均相对分子质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体 B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B可能都是气体
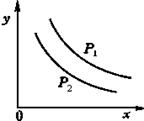 【练习14】反应L(s)+aG(g)
【练习14】反应L(s)+aG(g)
![]() bR(g)达到平衡时,温度和压强对该反应的影响如图所示。图中,压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示。图中,压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
A.上述反应是放热反应 B.上述反应是吸热反应
C. a>b D. a<b
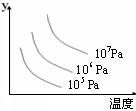 【练习15】某可逆反应L(s) + G(g)
【练习15】某可逆反应L(s) + G(g) ![]() 3R(g) ΔH>0,右图表示外界条件温度压强的变化对上述反应的影响。试判断图中Y轴可以表示( )
3R(g) ΔH>0,右图表示外界条件温度压强的变化对上述反应的影响。试判断图中Y轴可以表示( )
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
【练习16】反应mA(s)
+ nB(g) ![]() eC(g) + fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
eC(g) + fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
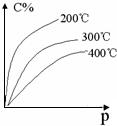 A.达到平衡后,加入催化剂,则C%增大
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n>e +f
D.达到平衡后,增加A的量有利于平衡右移
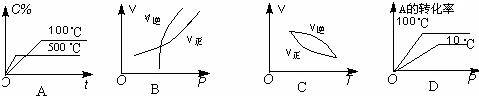 【练习17】如图所示,可逆反应:2A(g)+B(g)
【练习17】如图所示,可逆反应:2A(g)+B(g) ![]() 2C(g) △H<0的图像正确的是( )
2C(g) △H<0的图像正确的是( )
【练习18】对于可逆反应,A2(g)+3B2(g) ![]() 2AB3(g)△H<0,下列图像不正确的是( )
2AB3(g)△H<0,下列图像不正确的是( )
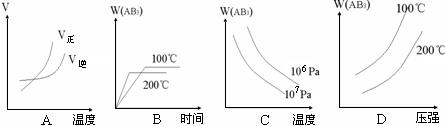
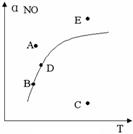 【练习19】在其它条件一定时,图中曲线表示反应
【练习19】在其它条件一定时,图中曲线表示反应
2NO(g)+ O2(g) ![]() 2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是( )
2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是( )
A.A或E B.B点
C.C点 D.D点
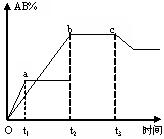 【练习20】反应A2+B2
【练习20】反应A2+B2![]() 2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应放热
C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
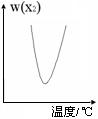 【练习21】两种气态单质按下列反应
【练习21】两种气态单质按下列反应
X2(g) + Y2(g)
![]() 2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应
2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应
化学反应速率、化学平衡图像参考答案
练习题
1.增大反应物的浓度;正向;降低温度;正向;增大压强;正向;使用催化剂
小结:浓度;温度或压强;使用催化剂
2.A 3.BD 4.D;A 5.D 6.(1)A(2)40%(3)2A ![]() B+3C
B+3C
7.BC 8.B 9.B 10.小、小、高、吸
11.C 12.A 13.CD 14.BD 15.C 16.BC 17.A 18.AC 19.C 20.B
21.放热反应