08届高考化学海珠区模拟试题(2008年3月)
本试卷分选择题和非选择题两部分,共8页,满分为150分。考试时间120分钟。
可能用到的原子量: H 1 C 12 N 14 O 16 Al 27 Ca 40 Fe 56 Cu 64
第一部分 选择题 (共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.2004年诺贝尔化学奖授予美国和以色列的三位科学家,以表彰他们在蛋白质降解的研究中取得的成果。下列关于蛋白质的说法中不正确的是( )
A.蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命
B.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
C.某些蛋白质跟浓硝酸作用会变黄
D.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
2、下列关于环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中的SO2
B.臭氧的体积分数超过10-14%的空气有利于人体的健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水污染
3、![]() U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关
U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关![]() U说法正确的是( )
U说法正确的是( )
A ![]() U原子核中含有92个中子 B
U原子核中含有92个中子 B ![]() U原子核外有143个电子
U原子核外有143个电子
C ![]() U与
U与![]() U互为同位素 D
U互为同位素 D ![]() 23592U与
23592U与![]() U互为同素异形体
U互为同素异形体
4、下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液
A.①④⑤⑥ B.②③④⑤ C.①②③⑥ D.②③④⑥
5、能证明氯化氢是共价化合物的现象是 ( )
A. 氯化氢极易溶于水 B.液态氯化氢不能导电
C.氯化氢在水溶液中是完全电离的 D.氯化氢是无色气体且有味
6、能正确表示下列反应的离子方程式是( )
A.碳酸氢钙溶液和氢氧化钠溶液混合
HCO3—+OH—==CO32—+H2O
B.醋酸钠溶液和盐酸混合
CH3COONa+H+ == CH3COOH + Na+
C. 少量金属钠放入冷水中
Na+ 2H2O== Na++2OH—+H2↑
D.硫酸铜溶液和氢氧化钡溶液混合
Cu2+ + SO42— +Ba2+ + 2OH—== Cu(OH)2↓+ BaSO4↓
7、NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
8、下列说法正确的是( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
9、已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol
10.室温时下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
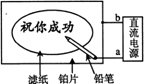
11、某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
12、下列有关实验的叙述正确的是( )
A.浓硝酸可保存在带橡皮塞的棕色细口瓶中
B.用pH试纸测定溶液pH时,pH试纸不应事先润湿
C.配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定
D.中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂
13、三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:
4NH3 + 3F2== NF3 + 3NH4F,下列有关NF3的叙述正确的是 ( )
A.NF3是共价化合物 B.NF3的还原性比NH3强
C.NF3的氧化性比F2强 D.NF3中的N呈+3价
14、右图是在恒温下某化学反应的反应速率随时间变化的示意图。下列说法不符合该示意图的是( )
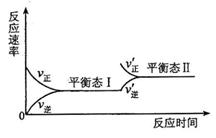 A.反应达到平衡时,正反应和逆反应速率相等
A.反应达到平衡时,正反应和逆反应速率相等
B.该反应达到平衡I以后,增大反应物的浓度,
平衡发生移动,达到平衡态II
C.反应达到平衡I以后,减小反应物浓度,平衡
发生移动,达到平衡态II
D.同一种反应物在平衡态Ⅰ和平衡态II时浓度
不相等。
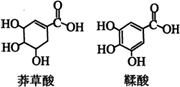 15、莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )
15、莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
16、在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是( )
A.c (Na+)==c(CH3COO-)+c(CH3COOH) B.c(H+)==c(CH3COO-)+c(OH-)
C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
17、pH=3的两种酸溶液A、B,分别与足量的锌反应,酸A比酸B产生的氢气的量多。下列说法正确的是( )
A. A是强酸、B一定是弱酸 B. A是弱酸、B一定是强酸
C. A是强酸、B是强酸 D. A酸性一定比B酸性弱
18、短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是( )
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
19、把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮 C.二氧化氮和氧气 D.二氧化氮和一氧化氮
20、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
第二部分 非选择题 (共80分)
三、(本题包括3小题,共30分)
21、(8分)W、X、Y、Z是前20号元素,已知:
①W的阳离子与Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X与Z位于同一周期元素,它们能够形成两种气态化合物;
④W与X可以形成WX2的化合物;
⑤X与Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
⑴W元素是 ;Z元素是 。
⑵化合物WY和WX2的化学式分别是 和 。
⑶Y和Z形成的两种常见化合物的分子式是 和 。
⑷写出X与Z形成的一种气态化合物跟WZ反应的化学方程式:
。
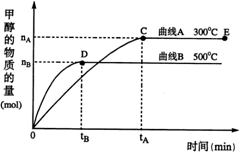 22、(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
22、(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= (用 nB tB 表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
23、(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
![]() 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
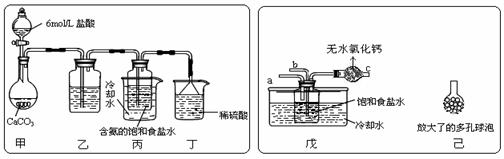
试回答下列有关问题:
![]() (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
四、(本题包括3小题,共30分)
24、(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
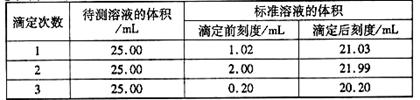 |
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
25、(12分)在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
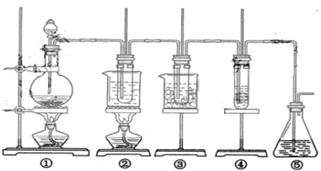
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
( l )制取氯气时,在烧瓶里加入一定量的二氧化锰.通过_______________________
 (填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
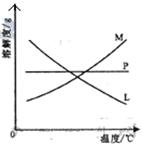
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该
晶体溶解度曲线的是_____________________(填写编号字母);从②的试管中分离出该晶体的方法是____________________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是: _______________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为____色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________________________ |
| 然后溶液从无色逐渐变为____色 | _______________________________________________ |
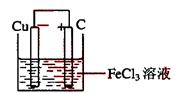
26、(10分)铁及铁的化合物应用广泛,如FeCl3可作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池装置图,标出正、负极,并写出电极反应式。
正极反应
负极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
五、(本题包括1小题,共10分)
27.(10分)碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A的分子式是 。
(2)A有2个不同的含氧官能团,其官能团名称是 。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是 。
②A不能发生的反应是(填写序号字母) 。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
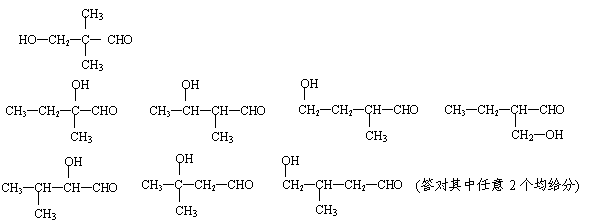
(4)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式:
、 。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是
。
六、选做题(本题包括2小题,每小题10分。考生只能选做一题,28小题为“有机化学基础”试题,29小题为“物质结构与性质”试题。)
28、(10分)奶油中有一种只含C、H、O的化合物A 。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
⑴A的分子式为___________。
已知: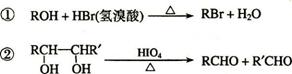
A中含有碳氧双键,与A相关的反应如下:
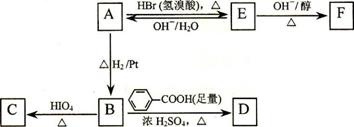
⑵写出A → E、E → F的反应类型:A → E ___________、E → F ___________。
⑶写出A、C、F的结构简式:A _____________、C ____________、F ___________。
⑷写出B → D反应的化学方程式:_________________________________________。
⑸在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:________________。A → G的反应类型为_________。
29、A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为____;
(2)B元素的负一价离子的电子层结构与氩相同,C元素的正一价离子的电子层结构与氙相同,B、C形成的化合物的化学式为 ;其晶体内每个B离子周围有 个C离子与之紧相邻。其晶体的主要物理性质有: _(写出两条即可)。
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为____________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其单质在一定条件下能与硫(S)反应,试写出该反应方程式 _______________________。
2008届高三化学模拟试题
参考答案
一.(本题包括10小题,每小题3分,共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | A | C | D | B | D | B | A | A | C |
二.(本题包括10小题,每小题4分,共40分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | BC | AD | C | AD | D | D | BD | C | D |
三、填空题
21、(8分)⑴Ca,O ⑵CaS,CaC2 ⑶SO2,SO3 ( 每空1分)
⑷CO2+CaO=CaCO3 (2分)
22、(8分)(1)K=c(CH3OH)/c(CO)·c2(H2) 减小 (每空1分)
(2)2nB/3tBmol·(L·min)-1 (2分) (3)b c (2分)
(4)Cu2O+CO![]() 2Cu+CO2 (2分)
2Cu+CO2 (2分)
23、(12分) (1)c (1分)
(2)①(Ⅰ)饱和碳酸氢钠溶液;(Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分));(Ⅲ)过滤 (每空1分,共3分)
②(Ⅰ)a、NH3, b、CO2; (每空1分,共4分)
(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率; (2分)
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可) (2分)
24、(10分)(l)① 偏高② 无影响③锥形瓶内溶液颜色的变化④ 无 粉红(或浅红) ( 2 ) 18.85 % (每小题2分)
25、(12分) ( l )分液漏斗 B (每空1分)
( 2 )碱溶液(或反应物)的浓度不同,反应温度不同(2分)
M 过滤 (每空1分)
( 3 ) Cl2 + 2OH-=ClO- + Cl一+H2O (2分)
( 4 ) (每空1分)
| 红 | |
| 氯气与水反应生成的HClO将石蕊氧化为无色物质 | |
| 黄绿 | 继续通入的氯气溶于水使溶液呈黄绿色 |
26、(10分)(1)2Fe3++Cu=2Fe2++Cu2+ (2分)
 (2)装置图(3分)
(2)装置图(3分)
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+) (1分)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+) (1分)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3] (3分)
27、(10分) (1)C5H10O2 (2)羟基 醛基 (每空1分)
 (3)
(3)
① (2分) ②b (1分)
(4)
(2分)
|
|
四、选做题
28、(10分)⑴.C4H8O2 ⑵.取代反应 消去反应 (每空1分)
⑶.![]() CH3CHO
CH3CHO ![]() (每空1分)
(每空1分)
⑷.![]() (2分)
(2分)
⑸.![]() 氧化反应 (每空1分)
氧化反应 (每空1分)
29、(10分)
(1)N。 (1分)
(2)CsCl(1分);8(1分),熔融时能导电、较高的熔点等(2分)。
![]() (3)Fe(1分);1s22s22p63s23p63d64s2或[Ar]3d64s2(2分)。
(3)Fe(1分);1s22s22p63s23p63d64s2或[Ar]3d64s2(2分)。
(4)2Cu+S Cu2S(2分,写出Cu但未写出正确方程式给1分)