08届高考化学科冲刺预测卷试题
原创
(扬州邗江中学,江都中学高三化学备课组监制)
注意事项:1.答卷前,考生务必用黑色碳素墨水的签字笔,将自己的姓名、考生号、试室号、座位号填写在答题卡。用2B铅笔将试卷类型(A或B)涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需要改动,用橡皮擦干净后,再选涂其它答案,答案不能写在试卷上。
3非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应的位置上;如需改动,先划掉原来的答案,再写上新的答案;不能使用铅笔和涂改液。不按以上作答的答案无效。
可能用到的相对原子质量: H-1 C-l2 O-16 Na-23 Cl-35.5 K-39
一、单选题(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
1.“嫦娥一号”成功发射,标志我国已具有深太空探测能力。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.![]() 和
和![]() 互为同位素 B.
互为同位素 B.![]() 原子核内含有4个质子
原子核内含有4个质子
C.![]() 原子核内含有3个中子 D.
原子核内含有3个中子 D.![]() 比
比![]() 多1个电子
多1个电子
2.目前,家庭装饰已成为一种时尚。随着装饰材料进入百姓家庭,新装修居室中常会缓慢释放出来污染物,进而影响人体健康。这些污染物中最常见的是
A.CO和SO2 C.O3和Cl2
C.SO2和NO2 D.HCHO和C6H6及其同系物
3.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:①向饱和碳酸钠溶液中通入过量的CO2;②向Fe(OH)3胶体中逐滴加入过量的稀硫酸;③向AgNO3溶液中逐滴加入过量氨水;④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
![]() 4.下列化学用语表达正确的是
4.下列化学用语表达正确的是
![]() A.丙烯的结构简式:CH3CH2CH2 B.乙酸的分子比例模型图为:
A.丙烯的结构简式:CH3CH2CH2 B.乙酸的分子比例模型图为:
C.次氯酸的结构式为:H—Cl—O D.Mg原子结构示意图:
5.下列化学反应属于吸热反应的是
A.碘的升华 B.生石灰溶于水 C.镁与稀盐酸反应 D.熟石灰与NH4Cl晶体混合制氨
6.下列电极反应正确的是
A.钢铁发生电化腐蚀的正极反应式:Fe -2e- == Fe2+
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.氯碱工业电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
D.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
7.下列各组离子可能大量共存的是
A.不能使酚酞试液变红的无色溶液中:Na+、CO![]() 、K+、ClO-、AlO
、K+、ClO-、AlO![]()
B.能与金属铝反应放出氢气的溶液中: K+、NO![]() 、Cl-、NH
、Cl-、NH![]()
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO![]()
D.含有HCO![]() 的溶液中:K+、OH-、NO
的溶液中:K+、OH-、NO![]() 、Ca2+
、Ca2+
8.R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)
A.若R、M的最高价氧化物的水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强
B.HnJOm为强酸,则G是位于VA族以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素
二、不定项选择题:在每题的四个选项中,有一个或两个选项符合题意。若正确答案只包括一个选项,多
选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,
但只要选错一个该小题就为0分(本大题包括6小题,每题4分,共24分)。
9.下列反应的离子方程式正确的是
A.Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O
B.向NaAlO2 溶液中通入过量CO2: AlO2-+CO2+2H2O = Al(OH)3↓+ HCO3-
C.向漂白粉溶液中通入SO2气体:Ca2++2C1O-+SO2 +H2O= CaSO3↓+2H C1O
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2+ +4H++NO3-==3Fe3++NO↑+2H2O
10.下列叙述中,不正确的是
A.在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分数
C.青石棉的化学式为Na2Fe5Si8O22(OH)2,用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
D.某离子被沉淀完全时,该离子在溶液中的浓度即为0
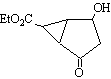
11.某化合物的结构(键线式)及球棍模型如下:
|
|
|
该有机分子的核磁共振波谱图如下(单位是ppm)。
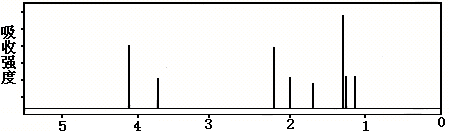
下列关于该有机物的叙述正确的是:
A.该有机物不同化学环境的氢原子有8种 B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为-CH3 D.该有机物在一定条件下能够发生消去反应
12. 下列说法正确的是
A.金属活动顺序表中,汞以前的金属都能被冷的浓硝酸、冷的浓硫酸氧化
B.Mg、Fe、Hg可以分别用电解法、还原剂还原法和直接加热法冶炼得到
C.由Mg、Al、NaOH溶液组成原电池,负极反应为:Al-3e- +2OH- = AlO![]() +H2O
+H2O
D.把2mol钠放入装有1mol氧气的集气瓶点燃,最后可得到1molNa2O
 13.用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,
13.用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,
则下列有关说法正确的是
A.阳极区酸性减弱
B.阴极区电极反应式为:2H++2e—=H2↑
C.该过程中的副产品主要为H2SO4
D.diluent和concentrated的中文含义为浓缩的、稀释的
14.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A.Y的最外层电子数为4 C.Y、Z两元素可以形成两种常见化合物
B.稳定性:Y的氢化物>Z的氢化物 D.X、Y两元素形成的化合物为离子晶体
三、(本题共17分)
15.(12分)请你与某小组的同学共同探究乙醇与乙酸的酯化反应实验:
(1)要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是:
。
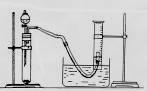
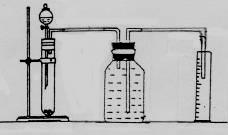
 (2)请你根据右边图示,补画实验室制取乙酸乙酯的装置图。其中小试管中装入的物质是 。
(2)请你根据右边图示,补画实验室制取乙酸乙酯的装置图。其中小试管中装入的物质是 。
(3)分离小试管中制取的乙酸乙酯应使用的仪器叫做 ;分离完毕,应从该仪器
(填:“下口放”或“上口倒”) 出。
(4)实验完毕,发现大试管中的反应液有些变黑,其原因是 。
(5)他们反复实验,得出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如下表:
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | X |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
表中数据X的范围是 ;实验①与实验⑤探究的目的是 ;
若乙醇价格为500元/kmol,乙酸价格为800元/kmol,乙酸乙酯价格为1600元/kmol,结合表中实验②③④的数据,你能得出的结论是 。
四、(本题包括2小题,共18分)
16.为确定某液态有机物X(分子式为 C2H6O2)的结构,某同学准备按下列程序进行探究。请完成下列填空。己知:①一个碳上连两个究基的物质
![]() 不稳定;
②分子中不存在过氧键 (-O-O一 ) 。
不稳定;
②分子中不存在过氧键 (-O-O一 ) 。
(1)根据价键理论预测 X 的可能结构为 、 、 (横线可不填满)
(2)设计实验方案证明 X 的结构 ( 表格可不填满 )
| 实验原理 | 预期生成H2的体积(标准状况) | 对应X的结构简式 |
| 取6.2gX与足量钠反应,通过生成氢气的体积来确定X分子中能与金属钠反应的氢原子数目,进而确定X的结构 | ||
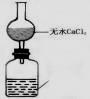
(3)根据实验方案,从下列仪器中选择所需仪器,画出实验装置图:

要求:①本题装置示意图中的仪器可以用上面的方式表示
②铁架台、石棉网、酒精灯、连接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,用“△” 表示。
17.(11 分 )铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
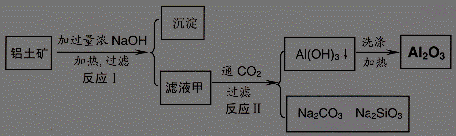
(1)滤液甲的主要成分是
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
a.AlO2― 或 Al(OH)4- b.OH― C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。写出阴极的电极反应方程式 ,沉淀消失的原因可用离子方程式表示为:
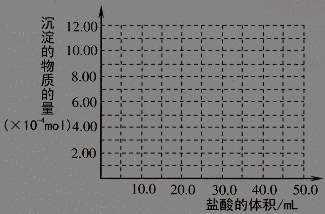
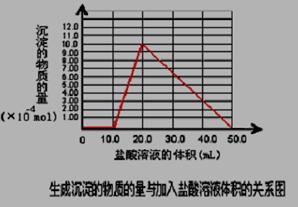
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。(解析两种等物质的量浓度的碱性溶质为NaOH,NaAlO2 )
五、(本题包括1小题,共10分)
18.(10分 )
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平方程式:口 Na2FeO2+ 口 NaNO2+ 口 = 口 NaFeO2+ 口 NH3↑+ 口 NaOH
(2)钢铁的“钝化”处理也能达到防腐目的,经冷、浓 HNO3 处理后,其表面有一层致密氧化物保护膜,但是加热或在稀 HNO3中 就不能 “钝化”。不同浓度的 HNO3 与铁反应的还原产物很复杂,其分布曲线如图。
①图示可知,密度为 1.05g·mL-1 的硝酸与铁反应时,其最多的还原产物是 ;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:
。
② mg 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO, 则 m 的取值可能是 (填字母编号 )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() E.
E.![]()
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
(3)金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
六、(本题包括1小题,共10分)
19.(10 分 )
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖 ( C6H12O6)。下列说法正确的是 ( 错选倒扣分 )
A.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)木糖醇 [ CH2OH(CHOH)3CH2OH]是一种甜味剂,糖尿病人食用后不会升高血糖。请预测木糖醇的一种化学性质 ( 写反应方程式 ):
(3)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物 A。A 的实验结果如下:
I、通过样品的质谱测得 A 的相对分子质量为 60
II、核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值 (信号),根据 峰值 (信号) 可以确定分子中氢原子的种类和数目。例如:乙醇 (CH3CH2OH) 有三种氢原子 (图1)。经测定,有机物 A 的核磁共振氢谱示意图如图2
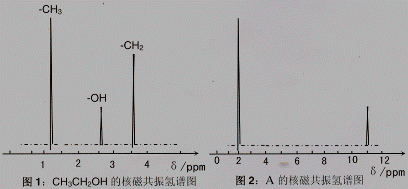
III、将 A 溶于水,滴入石器试液,发现溶液变红。
试推导写出 A 的结构简式为 。
(4)糖尿病人宜多吃蔬菜和豆类食品。蔬菜中富含纤维素,豆类食品中富含蛋白质。下列说法错误的是: (填序号,错选倒扣分)
A.蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B.用灼烧闻气味的方法可以区别合成纤维和羊毛
C.人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D.紫外线、医用酒精能杀菌消毒,是因为使细菌的蛋白质变性
E.用天然彩棉制成贴身衣物可减少染料对人体的副作用
(5)香蕉属于高糖水果,糖尿病人不宜食用。乙烯是香蕉的催熟剂,可使澳的四氯化碳溶液褪色,试写出该反应的化学方程式:
七、(本题包括1小题,共10分)
20.(10分)日常生活中使用铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
 |
一些氢氧化物沉淀的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为 。
(2)实验室进行步骤②③④的操作名称为 。
(3)固体A的化学式为 ,物质C的化学式为 ;溶液中的Na+、Ca2+、Mg2+是在步骤 中除去的。
(4)步骤③调节pH的数值范为 ,步骤④调节pH的数值范为 。
(5)步骤⑥反应的化学方程式为: 。
21A.物质结构与性质(共12分)
21.(10 分 )
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(![]() ) 和镍(
) 和镍(![]() ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
![文本框: I、镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。 +3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。
II、在Ni2+的溶液中加入强碱时,会生成 Ni(OH)2沉淀,在强碱性条件下,该沉淀可以被较强的氧化剂 (如 NaClO) 氧化为黑色的难溶性物质 NiO(OH) 。
III、镍易形成配合物如 Ni(CO)6、[Ni(NH3)6] 2+ 等。](http://shijuan.zww.cn/attachimg/tkgzhx/08jiegao226/image059.gif) E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
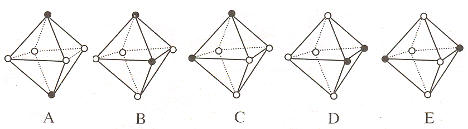
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
21B.实验化学(共12分)
26.(12分)辉钼矿(MoS2)是钼最重要的矿物。图26—1是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图26—2给出了各炉层的固体物料的摩尔百分组成。
已知:MoS2焙烧生成1molMoO3的反应热为△H1=-1011KJ/mol,MoO2氧化生成1molMoO3的反应热为△H2=-154KJ/mol。试回答:
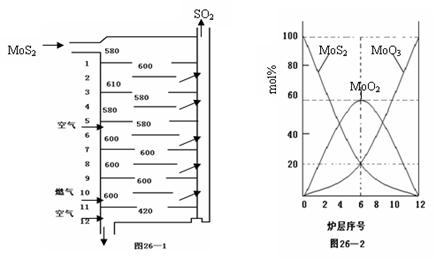
(1)辉钼矿焙烧生成MoO3的反应中被氧化的元素是: ;指出辉钼矿焙烧生成的尾气对环境的一种危害: 。
(2)第6炉层存在的固体物质分别是: ;它们的物质的量之比是: 。
(3)辉钼矿焙烧生成MoO3的热化学反应方程式是: 。
(4)图26—2表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的化学方程式: 。
(5)通过(3)和(4)你能解释为什么中间炉层(4~6)的炉温比上下炉层的炉温低吗?
。
化学试题参考答案及评分标准
一、单项选择题
1.A 2.D 3.C 4.B 5.D 6.C 7.C 8.A
二、不定项选择题
9.BD 10.D 11.AD 12. B 13.BC 14.C
三、(本题共17分)
15. 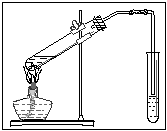 (1)(2分)先向大试管中加入3mL乙醇(1分),然后边振荡边摇动试管加入2mL浓硫酸和2mL乙酸(1分)[或最后加2mL浓硫酸]
(1)(2分)先向大试管中加入3mL乙醇(1分),然后边振荡边摇动试管加入2mL浓硫酸和2mL乙酸(1分)[或最后加2mL浓硫酸]
(2)(3分)见右图(大试管与水平线呈45º角、有溶液且画有固体沸石1分,导管略伸出橡胶塞、右边管口在液面上且离液面较近1分) 饱和碳酸钠溶液(1分,评讲时:为何不能用烧碱溶液?——酯发生水解)
(3)(2分)分液漏斗(1分) 上口倒出(1分)
(4)(1分)热浓硫酸将反应剩余的乙醇和乙酸炭化(评讲时:避免或减少炭化的措施?)
(5)(4分)1.57~1.76(或约为1.7,1分) 探究增加乙酸的反应量对乙酸乙酯产量的影响(1分) 由于存在化学平衡(1分),即使不断地增加廉价原料,产物的量增加也越来越少(或经济效益越来越低,1分)
四、(本题包括2小题,共18分)
16、(7分)(1)CH3-O-CH2-OH CH2OH-CH2OH
(2)(预期生成H2的体积与对应X的结构简式都对才得1分,只答对一部分不得分;体积没有单位合并扣1分,单位用毫升表示不扣分)
| 实验原理 | 预期生成H2的体积(标况) | 对应X的结构简式 |
| 取6.2克的X与足量钠充分反应,通过生成氢气的体积来确定X分子中能与金属钠反应的氢原子的数目,进而确定X的结构 | 1.12L | CH3-O-CH2-OH |
| 2.24L | CH2OH-CH2OH | |
(3)(装置可参考图示1或2,其它如附图的合理答案也得分。进气管和出水管的顺序颠倒扣1分)
 | |||||
 | |||||
 | |||||
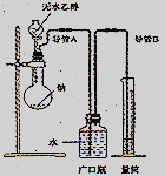 图示1
图示2
图示1
图示2
 | |||
 | |||
17.(11分)(1)NaOH、NaAl(OH)4(NaAlO2)、Na2SiO3 [或氢氧化钠、铝酸钠(偏铝酸钠)、硅酸钠](1分)
(2)CO2+2OH-==HCO3-+2H2O (1分) ,CO2+3H2O+2AlO2-==2Al(OH)3↓+2H2O-+CO32- (1分)
(3) bac (2分) ;
 (4)2H2O+2e-→2OH-+H2↑(2分) ;Al(OH)3
+OH-=Al(OH)4- 或Al(OH)3 +OH-=AlO2-+2H2O (2分)
(4)2H2O+2e-→2OH-+H2↑(2分) ;Al(OH)3
+OH-=Al(OH)4- 或Al(OH)3 +OH-=AlO2-+2H2O (2分)
(5)(2分)
五、(本题包括1小题,共10分)
18 (10-分)(1)![]() (2分)
(2分)
(2)①NH3 或NH4+ (1分);其规律是:硝酸的浓度越大,其还原产物中氮元素化合价越高。(2分)
(其它合理答案均给分。如硝酸的浓度越大,气体生成物中二氧化氮的含量越高;或者,只在硝酸浓度较低时,产物中才会出现氮气。等等)
②B、C、D (对一个或两个给一分,全对2分,但只要出现A、E便不给分) (2分)
③硝酸易挥发,且不稳定,见光易分解,故不易操作;生成物对环境污染严重 (2分)
(3)A.B.D.(2分)(对一个或两个给一分,全对2分,但只要出现C便不给分)
六、(本题包括1小题,共10分)
19. (共10分) (1)BCD;(共2分,答对两个给1分全对给2分,错选A倒扣1分,答ABCD为0分)
(2)能与羧酸发生酯化反应(或其它合理的答案均可);(2分)
(3)CH3COOH;(2分,写结构式不给分)
(4)AC;(2分,选对一个给一分,错选一个倒扣一分,扣完本小题分为止)
(5)CH2=CH2 + Br2 → CH2Br—CH2Br;(2分,有机物写分子式不给分、写结构式给分,“→”写“=”不给分)
七、(本题包括1小题,共10分)
20.(10分)(1)(2分)Al2O3+6H+==2Al3++3H2O (2)(1分)过滤
(3)(3分)SiO2 NaOH溶液[或Ca(OH)2溶液] ④
|
5.2<pH<10.4 (或6<pH<10)
(5)(2分)2Al2O3(熔融)====4Al+3O2↑
八(选做题)
21A.物质结构与性质(共12分)
21.(共12分)
(1)LaNi5 + 3H2 ![]() LaNi5H6;(2分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
LaNi5H6;(2分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
(2)CE (2分,每选对一个给一分,每错选一个倒扣一分,扣完本小题分为止)
(3)①[Ar]3d7;或![]() (2分,写成3d7不给分)
(2分,写成3d7不给分)
②2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(3分,未配平不给分,氯气未写气体符号扣一分)
(4)A和B(或A和C、A和D、B和E、C和E、D和E任一组均可);(3分,若同组中出现同种物质则不给分,例如AE、BC……等)
21B.实验化学(共12分)
22(12分)
(1)Mo和S;形成酸雨(合理即得分)。(每空各1分)
(2)MoS2、MoO3、MoO2;1:1:3。(每空各1分)
(3)MoS2 (s)+ 3.5O2 (g)= MoO3(s) + 2SO2(g) △H1=-1011KJ/mol.(2分)
(4)MoS2 + 6MoO3 = 7MoO2 + 2SO2(不标条件不扣分)(2分)
(5)由① MoS2 (s)+ 3.5O2 (g)= MoO3(s) + 2SO2(g) △H1=-1011KJ/mol和
② MoO2(s)+ 0.5O2 (g)= MoO3(s) △H2=-154KJ/mol
得反应③MoS2 (s)+ 6MoO3 (s)= 7MoO2 (s)+ 2SO2(g)
△H3=△H1-7△H2=-1011KJ/mol-(-154KJ/mol)×7=67KJ/mol,因为△H3>0,故反应③是吸热反应,因其发生在中间层,故炉温降低。(4分)