高考化学总复习测试题<三>
注意事项:1.本试卷总分100分,考试时间90分钟。
2.第I卷选择题答案答在答案卡上
3.可能用到的相对原子质量:H-1 O-16 Na-23 Mg-24 Al-27 Fe-56 Cu-64
一、选择题(本大题包括30个小题,共60分。每小题只有一个正确选项)
1.下列所用材料不属于合金的是
A.家用的铝窗 B.建筑用的钢筋
C.铸造用的黄铜 D.温度计用的水银
2.从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是:①地壳中的金属元素的含量;②金属活动性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性;
A.①③ B.②⑤ C.③⑤ D.②④
3.某溶液由相同物质的量的CuCl2、FeCl3、AlCl3混合而成,向该溶液中加入铁粉,充分搅拌后振荡,铁粉仍有剩余,则溶液中存在较多的阳离子是( )
A.Fe3+、Cu2+ B.Fe3+、Al3+ C.F e2+、Al3+ D.Fe2+、Fe3+
4.下列关于Na和Na+ 的叙述中,错误的是
A.具有相同的质子数 B. 它们的化学性质相似
C.钠离子是钠原子的氧化产物 D. 灼烧时火焰都呈黄色
5.下列说法正确的是( )
A、食盐不是盐 B、火碱不是碱 C、纯碱不是碱 D、干冰不是冰
6.将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是
A.Cu2+和Fe2+ B.H+和Cu2+ C.Fe3+和Fe2+ D.Fe2+和Mg2+
7. 金属钠应存放于① 煤油 ② 石蜡油 ③ 四氯化碳 ④ 密闭容器
A.①②③ B.②③④ C.①②④ D.①②③④
8.下列物质中不能与氢氧化钠反应的是( )
A、碳酸钠 B 碳酸氢钠 C 氢氧化铝 D 氯化铁
9.下列块状金属在常温时能全部溶于足量浓HNO3的是
A . Ag B . Cu C. A1 D . Fe
10.下列物质中属于离子化合物的是
A. 苛性钠 B . 碘化氢 C. 硫酸 D. 醋酸
11.下列物质中可用于治疗胃酸过多的是
A.氧化钙 B.氢氧化铁 C.碳酸氢钠 D.碳酸钠
12.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在下列使用场合中,必须加以控制的是
A.制造炊具 B.制防锈油漆 C.制铝合金窗 D.炼铝厂制造铝锭
13.下列4种鉴别碳酸钠和碳酸氢钠的方法中,可靠性最差的是
A.观察样品外观 B.在少量的样品中滴入几滴水
C.在饱和溶液中滴入几滴酚酞 D.取少量的试样加热
14.将Na2O2投入FeCl2溶液中, 可观察到的现象是
A.生成白色沉淀、有气泡产生 B.生成红褐色沉淀、有气泡产生
C.生成浅绿色沉淀、有气泡产生 D.生成黑色沉淀,有气泡产生
15.金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是:① 密度较小 ②熔点较低 ③ 硬度较小 ④还原性强 ⑤ 该反应生成相应的碱 ⑥ 该反应是放热反应
A.①②③④⑤ B.①②④⑤⑥ C.除③⑥之外 D.全部
16. 若3.6g某金属跟足量盐酸充分反应,放出4.48L(标准状况)氢气,则该金属是
A. Al B. Mg C. Fe D. Zn
17. 在酸性溶液中,能大量共存的离子是
A.Mg2+、Fe3+、NO3-、SCN- B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3- D.Na+、Ca2+、NO3-、SO42-
18.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是
A. NaOH B. NH3·H2O C. AgNO3 D. BaCl2
19.金属钠着火时,可采用的灭火物质是
A.泡沫灭火器 B.水 C. 煤油 D.砂子
20.在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
 A.Mg2+、Al3+、Fe2+
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
21. 将适量的铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则反应的Fe3+和Fe3+为反应的物质的量之比是
A.3:2 B.2:3 C.1:2 D.1:1
22.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是
A.1:1 B.1:2 C. 1:3 D. 3:2
23. 下列反应的离子方程式书写正确的是
A.钠和冷水反应: Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2
C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
D.铜和硝酸银溶液反应: Cu + 2Ag+ = 2Ag + Cu2+
24. 甲、乙、丙、丁分别是![]() 、
、![]() 、NaOH、
、NaOH、![]() 四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.![]() B.NaOH C.
B.NaOH C.![]() D.
D.![]()
25下列操作中,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.铁丝置于氯化铜溶液中一段时间 D.氯化铁溶液中加入还原性铁粉
26.向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。由于CO2通入量不同,所得到的白色固体不可能的是
A. K2CO3 KOH B. K2CO3 C. K2CO3 KHCO3 D. KOH KHCO3.
27.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有
A.Cu2+ B.Mg2+ C.Al3+ D. ![]()
28.下列各组物质的溶液中,分别加入足量氨水,观察到的现象相同的是
A. FeCl3, AlCl3 B. NaCl, BaCl2 C. MgCl2, CuCl2 D. FeCl2, FeCl3
29.(1993)a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为
A. Fe Cu Al Ag Mg B. Al Cu Mg Ag Fe
C. Mg Cu Al Ag Fe D. Mg Ag Al Cu Fe
30下列生产目的能达到的是
A.AlCl3溶液与Na2S溶液反应制Al2S3
B.用浓H2SO4与溴化钠反应制取溴化氢
C.用铝粉与软锰矿(含MnO2)可制得锰
D.用镁粉和空气反应可制得Mg3N2
高考化学总复习测试题<三>
学号____________ 姓名___________ 成绩____________
第 I卷 选择题(共60分)答案卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第II卷 非选择题(共40分)
二、填空题
31.(6分)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质,于是取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴 溶液,若溶液颜色呈现 ,说明样品有变质,若溶液 ,则未变质。如果该样品变质,应加入 除去变质的杂质,有关的化学方程式为
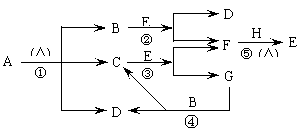 32.(18分)已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以冶疗胃酸过多。E为淡黄色固体,B、F通常条件下为无色的气体 。A~H各物质的变化关系如下图所示。
32.(18分)已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以冶疗胃酸过多。E为淡黄色固体,B、F通常条件下为无色的气体 。A~H各物质的变化关系如下图所示。
(1)写出各步反应的化学方程式
反应①
反应②
反应③
反应④
反应⑤
(2)上述反应中属于氧化还原反应的有 。
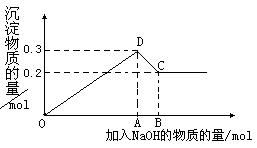 33.(16分)在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如右图所示。
33.(16分)在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如右图所示。
(1)写出代表各线段发生反应的离子方程式:
OD段 ,
CD段 ,
(2)原溶液中Mg2+、Al3+物质的量浓度之比为 。
(3)图中C点表示当加入 mol NaOH时,Al3+已经 ,Mg2+已经 。
(4)图中线段OA∶AB= 。
(5)若得到0.25 mol的沉淀,则加入NaOH物质的量为 。
2007年海南高考化学总复习测试题<三>(参考答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | D | C | B | C | D | C | A | B | A | C | A | A | B | B |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | B | C | A | D | B | B | A | D | D | A | D | D | B | C | C |
二、非选择题 (40分)
31.KSCN,血红色,不呈红色,少量还原铁粉(2分)
|
|
⑤ 2Na + 02 ==== Na2O2 (2)反应②、③、⑤l
33. (1)略(2)2∶1(3)0.8 全部溶解生成NaAlO2、完全生成沉淀Mg(OH)2(4)7∶1(5)0.45 mol或0.75 mol
高考化学总复习测试题<三>(参考答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | D | C | B | C | D | C | A | B | A | C | A | A | B | B |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | B | C | A | D | B | B | A | D | D | A | D | D | B | C | C |
二、非选择题 (40分)
31.KSCN,血红色,不呈红色,少量还原铁粉(2分)
|
|
⑤ 2Na + 02 ==== Na2O2 (2)反应②、③、⑤l
33. (1)略(2)2∶1(3)0.8 全部溶解生成NaAlO2、完全生成沉淀Mg(OH)2(4)7∶1(5)0.45 mol或0.75 mol