高考化学文化补习学校第四次周考试题
化 学(问卷) 命题:郑文
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共8页,有4大题28小题,满分为100分,考试时间100分钟。
2.本卷答案必须写在答卷Ⅰ、Ⅱ的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、学号、试场号、座位号分别填写在答卷Ⅰ、Ⅱ的相应位置上。考试结束后只需上交答卷Ⅰ、Ⅱ,考试时不能使用计算器。
4.本试卷可能用到的相对原子质量:H—1,C—12,O—16,K—39,Ca—40,V—51
第Ⅰ卷(选择题部分,共40分)
一、选择题:(以下每题只有1个选项符合题意,2′×20)
1.位于美国加利福尼亚州利弗莫尔的劳伦斯—利弗莫尔国家实验所和位于俄罗斯杜布纳的联合原子核研究所联合研究小组在2006年10月16日宣布,他们成功制造出了门捷列夫元素周期表中的118号元素。下列说法错误的是 ( )
A.118号元素元素应该位于元素周期表的0族元素氡之下
B.制造出的新的118号元素的一个原子中子数为179,则该原子的摩尔质量为297
C.目前还没有发现117号元素的报道,推测117号元素应该属于金属元素
D.118原子可释放出一颗由两个质子和两个中子组成的阿尔法粒子,衰变为已知的116号元素该过程不属于化学变化
2.结束不久的中共十六届六中全会,审议了《中共中央关于构建社会主义和谐社会若干重大问题的决定》,其中人与自然和谐相处,是社会主义和谐社会的六个基本特征之一。对此,中央已明确提出建设资源节约型社会和环境友好型社会的战略任务,并将其列为“十一五”的重要目标。下列说法不符合人与自然和谐相处的是: ( )
A.很多城市对废旧电池进行回收处理
B.许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理
C.现在不少地区正在使用沼气,太阳能,风能等能源替代传统的煤炭
D.许多地方政府出台相关法规来保护生物物种多样性
3.下列各组稀溶液,不用其它试剂就可以将它们区别开的是: ( )
A.盐酸、氢氧化钾、硫酸钾、碳酸钾 B.硝酸钠、盐酸、氯化铵、氢氧化钾
C.氢氧化钾、碳酸钾、硫酸镁、硫酸氢钾 D. 氯化钡、氯化钙、硫酸钠、硝酸钾
4. 吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内活性氧,则Na2SeO3的作用是:( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
5.居里夫人,被誉为“镭的母亲”, 发现了镭,使全世界都开始关注放射性现象。镭(Ra)位于周期表的第七周期ⅡA族。下列关于镭的性质的描述你认为不正确的是: ( )
A. 在化合物中呈现+2价 B. 单质能与水反应产生氢气
C. 氢氧化物是强碱 D. 碳酸盐易溶于水
6. 下列有关物质性质的比较正确的是: ( )
A.熔点、沸点:F2﹥Cl2﹥Br2﹥I2
B.离子半径:F-﹥Na+﹥Mg2+﹥Al3+
C.碱性:LiOH﹥NaOH﹥KOH﹥RbOH
D.Na2CO3水溶液中:c(Na+)﹥c(CO32-)﹥c(HCO3-)﹥c(OH-)﹥c(H+)
7.室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为: ( )
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
8.最近广东北江发生严重的水体污染事件,专家确定用1200吨的聚合铁(简称PFS,化学式为:![]() )分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
:
( )
)分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
:
( )
A.10848Cd核素中中子数为60
B.含镉废电池应进行回收处理
C.PFS中铁显+2价
D.实验室由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
9. 有50mL某气体,可能含有CO2、O2、NH3等气体,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为 : ( )
A.CO2为20mL,NH3为30mL B.NH3为40mL,O2为10mL
C.CO2为30mL,O2为20mL D.CO2为40mL,O2为10mL
10.某同学用Na2CO3配制0.10mol·L-1Na2CO3(aq)的过程如下图所示:
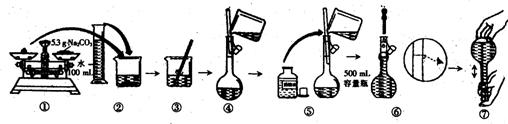
你认为该同学的错误有( )
A.1处 B.2处 C.3处 D.4处
11.下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
| I | II | |
| A | 少量CO2通和NaOH溶液中 | 过量CO2通入少量NaOH溶液中 |
| B | 少量NaOH溶液滴入Al2(SO4)3溶液中 | 少量Al2(SO4)3溶液滴入浓氨水中 |
| C | 0.1molCl2通入含0.2molFeBr2的溶液中 | 0.3mol Cl2通入含0.2mol FeBr2的溶液中 |
| D | 过量BaCl2溶液与少量Na2SO4溶液相混合 | 少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
12. 设NA为阿伏加德罗常数,下列叙述合理的是: ( )
A.通常状况下,1molNaHCO3投入足量稀盐酸中,反应完后,可逸出NA个CO2分子
B.在含有1mol CH3COO-的醋酸钠溶液中, Na+数目略大于NA
C.46gNO2和N2O4混合气体中含有原子数大于3NA
D.22.4L的O3分子所含原子数为3NA
13.下列各溶液中,微粒的物质的量浓度关系不正确的是: ( )
A. 10mL 0.5mol/L CH3COONa溶液和6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>
c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
 D. c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c
D. c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c![]()
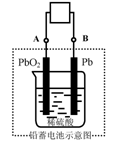
14. 随着石油资源不断减少,石油价格不断上扬,相对环保型的电瓶车愈来愈受到人们的喜爱。电瓶车所用电池一般为铅蓄电池,这是一种可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O 则下列说法正确的是
2PbSO4+2H2O 则下列说法正确的是
A.放电时:电子流动方向由A到B
B.放电时:正极反应是Pb-2e-+SO42-=PbSO4
C.放电时:B极为正极,A极为负极
D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+
15. 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g )+3H2(g)![]() 2NH3(g),△H ﹤0。673K、30Mpa下n(NH3)和n(H2)随时间变化的
2NH3(g),△H ﹤0。673K、30Mpa下n(NH3)和n(H2)随时间变化的
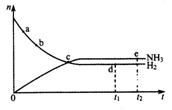 关系如图所示。下列叙述正确的是:( )
关系如图所示。下列叙述正确的是:( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小
16. 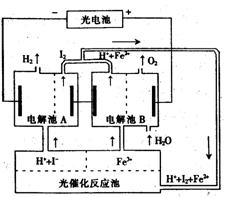 某研究小组设计了如图所示的循环系统,来生产能解决能源危机的某种物质,其中所需的电能由太阳能光电池提供。有关叙述正确的是( )
某研究小组设计了如图所示的循环系统,来生产能解决能源危机的某种物质,其中所需的电能由太阳能光电池提供。有关叙述正确的是( )
A.该循环系统的目的是制I2
B.电解池A中离子反应方程式:H2+I2![]() 2H++2I-
2H++2I-
C.光催化反应池中离子反应方程式为:
2Fe2++I2![]() 2Fe3++2I-
2Fe3++2I-
D.该系统中的Fe3+、O2、I-都是循环使用的物质
17.下列说法可以实现的是:①酸性氧化物均能与碱发生反应;②盐溶液与弱酸反应可以生成强酸;③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成;④两种酸溶液充分反应后,所得溶液呈中性;⑤有单质参加反应,但该反应不是氧化还原反应
A.②③④⑤ B.①③④⑤ C.①②③⑤ D.①②③④⑤
18.已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为
A.1.5mol/L B.1 mol/L C.2 mol/L D.无法确定
19.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
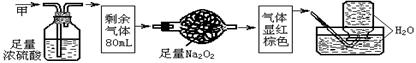
20.某同学测定某一气体样品中CO的浓度:第一步,将2.00L气体样品通入盛有I2O5固体的反应管中,反应生成CO2和I2;第二步,用60.00mL 2.5×10-3mol·L-1的Na2S2O3吸收产生的I2(I2+2S2O32-==2I-+S4O62-);第三步,取上述反应后溶液体积的![]() ,用标准溶液碘水(1.00×10-2mol·L-1)滴定过量的Na2S2O3,消耗碘水的体积为1.25mL,则样品中CO的浓度(mg·L-1)为( )
,用标准溶液碘水(1.00×10-2mol·L-1)滴定过量的Na2S2O3,消耗碘水的体积为1.25mL,则样品中CO的浓度(mg·L-1)为( )
A. 1.25×10-4 B. 3.5 C. 6.25×10-5 D. 1.75
第IⅠ卷(非选择题部分,共68分)
21.(10分)我们知道自然界中的蜘蛛丝和细菌纤维素纤维是典型的纳米纤维。较细的蜘蛛丝直径还不足100纳米,是真正的天然纳米纤维。美国与加拿大的科学家合作,采用蜘蛛基因,利用仿生结构,成功地纺制出人造蜘蛛丝,其强韧性能优于钢材。
(1)纳米纺织材料凭借其内部所特有的小尺寸效应、表面效应等日益受到广大消费者的
喜爱。许多纳米材料的粒子直径都在1~100nm之间,从分散系的角度看应该属于
(2) 纳米是长度单位,物质的颗粒达到纳米级时,具有不同的性质,如果单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,下列对“纳米铜”的说法正确的是: (填序号)
A.“纳米铜”与铜片还原性相同
B.“纳米铜”比铜片更易失电子
C.“纳米铜”比铜片的氧化性强
(3)钢铁在人们生活中应用非常广泛,但是钢铁因腐蚀造成的损失全球每年高达7000亿美元,目前钢铁被腐蚀的主要形式是吸氧腐蚀,其正极发生 反应,负极发生的电极反应式为 。为了减少这种腐蚀生产生活中常见的有哪些防腐措施: 。(至少填两种措施)
21.(10分)二氧化氯(ClO2)作为替代传统多氯漂白工艺的最佳漂白剂、消毒杀菌剂和水处理剂,其生产和应用有着广阔的前景。ClO2在常温下是一种黄绿色气体;在酸性溶液中比较稳定;在碱性溶液中迅速生成ClO2-和ClO3-混合物。
(1)ClO2起消毒杀菌作用是利用了它具有______的化学性质,生成物中氯元素呈_____价。
(2)写出ClO2与NaOH溶液反应的化学方程式_____________________________________。若有0.1molClO2参加反应,则转移的电子的物质的量为______mol.
(3)国际上关ClO2生产工艺和制备方法的研究一直很活跃,仅成型的生产工艺就有十几种之多,其中有一种是用NaClO3和NaCl为原料,反应必须在酸性溶液中进行。现仍用NaClO3为原料,只需加入另一种原料即可,请完成这一化学反应方程式:
□NaClO3 +□![]() → □ClO2↑ + □Cl2↑ + □NaCl +□
→ □ClO2↑ + □Cl2↑ + □NaCl +□![]()
22.(14分)有一瓶澄清的溶液.其中可能含有NH4+, K+, Mg2+, Ba2+, Al3+, Cl-, I-, NO3-, CO32-, SO42-中的几种。取该溶液进行以下实验。
(1)用pH试纸检验,表明溶液呈现强酸性,排除_______的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4呈紫红色,排除___的存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生,则可排除_______的存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色溶液生成,证明________存在,又排除________存在。
(5)综上所述,该溶液中上述离子尚不能确定是否存在的是_______
(6)若要确认(5)中相关离子,确认的实验方法是______________________________。
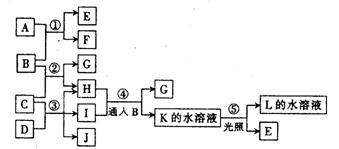 23.(12分)根据下列反应框图填空。已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物。A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,F、G均能与L的水溶液反应放出B。
23.(12分)根据下列反应框图填空。已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物。A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,F、G均能与L的水溶液反应放出B。
(1)F的俗名是_______,工业上利用反应③生产_______。
(2)反应①—⑤中,属于氧化还原反应的是__________。
(3)反应④的离子方程式为____________________、
(4)有一种单质能与H反应生成E,该反应的化学方程式为________。
(5)某气体M具有漂白性,既有氧化性,又有还原性,请写出同时有B、H和M生成的化学方程式___________________________。
24.(16分)已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A单质是自然界中密度最小的气体,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体可以和氢氧化钠反应放出无色刺激性气味气体E。请回答下列问题:
(1) 写出B单质的电子式 ;C和D形成淡黄色固体化合物电子式 。
(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为 其水溶液
显 性,用离子方程式说明 。
(3) E分子的空间构型是 ,属于 分子(填极性或非极性)
(4) A、B、C三种元素还可以形成另一种化合物,其热的浓溶液可以溶解铝和铁,但常
情况下它的浓溶液又可盛放在铝或铁制的容器中,原因是
。
25.(6分)有人在古玩市场买了个元宝,专家鉴定认为是由铜和银的合金制造的,为了测出该合金中银的质量分数,专家将30.0g该合金溶于80mL 13.5 mol/L的浓硝酸中,合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的c(H+)=1.0mol/L。假设反应后溶液体积不变,试计算:(1)被还原硝酸的物质的量。(2)合金中银的质量分数。
 2007届道县高考文化补习学校第四次周考试题2006 .11 .23
2007届道县高考文化补习学校第四次周考试题2006 .11 .23
化 学(答卷)
第Ⅰ卷(选择题,共40分)
一、选择题(每小题只有1个选项符合题意,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷(非选择题,共60分)
21.(10分)(1)从分散系的角度看应该属于
(2)下列对“纳米铜”的说法正确的是: (填序号)
(3)其正极发生 反应,
负极发生的电极反应式为 。
防腐措施: 。(至少填两种措施)
21.(10分)(1)ClO2具有______的化学性质,生成物中氯元素呈_____价。
(2)写出ClO2与NaOH溶液反应的化学方程式_____________________________________。若有0.1molClO2参加反应,则转移的电子的物质的量为______mol.
(3)□NaClO3 +□![]() → □ClO2↑ + □Cl2↑ + □NaCl +□
→ □ClO2↑ + □Cl2↑ + □NaCl +□![]()
22.(14分)
(1)用pH试纸检验,表明溶液呈现强酸性,排除_______的存在。
(2)排除___的存在。
(3)则可排除_______的存在。
(4)证明________存在,又排除________存在。
(5)综上所述,该溶液中上述离子尚不能确定是否存在的是_______
(6)若要确认(5)中相关离子,确认的实验方法是______________________________。
23.(12分)
(1)F的俗名是_______,工业上利用反应③生产_______。
(2)反应①—⑤中,属于氧化还原反应的是__________。
(3)反应④的离子方程式为____________________、
(4)有一种单质能与H反应生成E,该反应的化学方程式为________。
(5)某气体M具有漂白性,既有氧化性,又有还原性,请写出同时有B、H和M生成的化学方程式___________________________。
24.(16分)
(1) 写出B单质的电子式 ;C和D形成淡黄色固体化合物电子式 。
(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为 其水溶液
显 性,用离子方程式说明 。
(3) E分子的空间构型是 ,属于 分子(填极性或非极性)
(4) A、B、C三种元素还可以形成另一种化合物,其热的浓溶液可以溶解铝和铁,但常
情况下它的浓溶液又可盛放在铝或铁制的容器中,原因是
。
25.(6分)有人在古玩市场买了个元宝,专家鉴定认为是由铜和银的合金制造的,为了测出该合金中银的质量分数,专家将30.0g该合金溶于80mL 13.5 mol/L的浓硝酸中,合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的c(H+)=1.0mol/L。假设反应后溶液体积不变,试计算:(1)被还原硝酸的物质的量。(2)合金中银的质量分数。
[答案]
第Ⅰ卷(选择题部分,共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | C | B | D | D | D | D | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | B | C | D | A | C | D | C | B | D |
第Ⅱ卷(非选择题,共60分)
21.(10分)(1)胶体 (2 ) B
(3)还原; Fe—2e—= Fe2+;
改变金属内部结构、表面涂层防护、利用原电池原理
22.(1)强氧化性;-1
(2)2ClO2+2NaOH==NaClO2+NaClO3+H2O;0.05
(3)2,4,HCl,2,1,2,2,H2O
23.(1)CO32- (2)NO3- (3)Mg2+、Al3+ (4) Ba2+ , SO42-
25.(9分)(1) ∶N![]() N∶ (1分) ; Na+[
N∶ (1分) ; Na+[![]() O∶O
O∶O![]() ]2-Na+ (1分)
]2-Na+ (1分)
![]() (2)硝酸铵(1分),酸性(1分),NH4++H2O
(2)硝酸铵(1分),酸性(1分),NH4++H2O![]() NH3·H2O+H+(1分)
NH3·H2O+H+(1分)
(3)三角锥型(1分),极性(1分)
(4)常温下,浓硝酸能够使铝、铁等金属表面生成一薄层致密的氧化物薄膜,从而阻止内部金属继续跟硝酸发生反应(2分)
26.(10分)解:(1)![]() =0.3(mol) 该气体可能是NO2或NO、NO2,根元素守恒,被还原的硝酸就是0.3mol. (4分)
=0.3(mol) 该气体可能是NO2或NO、NO2,根元素守恒,被还原的硝酸就是0.3mol. (4分)
(2)c(H+)=1.0(mol/L) (1分)
参加反应的HNO3(13.5-1)×0.08=1(mol) (1分)
求未被还原的硝酸为(1-0.3)mol(1分)
设Ag为x(g)
![]()
x=10.8(g) (1分) w(Ag)= ![]() (2分)
(2分)
