高考化学第一轮综合测试试卷(四)
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 Br:80
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案):
(D )1. 下列离子方程式正确的是
A.氯化铝溶液加入氨水:Al3+ + 3OH-Al(OH)3 ↓
B.实验室用氯化铵和熟石灰制氨气:NH4++OH—==NH3↑+H2O
C.碳酸氢钙溶液加入盐酸:CO32—+2H+==H2O+CO2↑
D.硫酸铵溶液跟氢氧化钡溶液混合:2NH4++SO42—+Ba2++2OH—==BaSO4↓+2NH3·H2O
(C )2. 下列气体,不能用排空气法收集的是
A.CO2 B.NO2 C.NO D.H2
( B )3. 仅用水,不可能除净除尽杂质气体的是
A.氢气中的氨气 B.氧气中的二氧化碳
C.空气中的氯化氢 D.一氧化氮中的二氧化氮
( D )4.pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则溶液中c(H+)为(mol/L)
A. (4×10-9 + 1×10-12) 1/5 B. (8×10-9 + 1×10-12) 1/5
C. 5×10-10 D. 5×10-12
( D )5.将pH=8的Ba(OH)2溶液加水稀释1000倍,稀释后所得溶液中Ba2+浓度与OH-浓度之比为
A. 1:2 B. 1:200 C.1:50 D. 1:100
( A )6.用水稀释0.1mol/L的醋酸溶液,其中随水的增加而最终增大的有
①H+的物质的量 ②c(H+) ③c(OH—) ④c(H+)/c(HAc) ⑤c(HAc)/c(Ac-)
A. ①③④ B. ①③⑤ C. ②④ D. ③④
( B )7.某强酸溶液pH=a , 强碱溶液pH=b, 已知a+b=16,在常温下混合后pH=7,则酸溶液体积V酸和碱溶液的体积V碱的准确关系是:
A. V碱=102V酸 B. V酸=102V碱 C. V酸=2V碱 D. V碱=2V酸
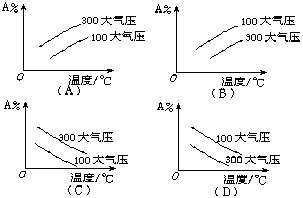
( B )8.在可逆反应mA(g)+nB(g) ![]() pC(g)中,m、n、p为系数,且m+n>p,正反应是放热反应。分析下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是
pC(g)中,m、n、p为系数,且m+n>p,正反应是放热反应。分析下列各图,在平衡体系中A的质量分数与温度toC、压强P关系正确的是
—1—
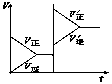 ( D )9.对于达平衡的可逆反应X+Y
( D )9.对于达平衡的可逆反应X+Y![]() W+Z,增大压强则正、逆反应速率(v)的变化如图,分析可知X、Y、Z、W的聚集状态可能是
W+Z,增大压强则正、逆反应速率(v)的变化如图,分析可知X、Y、Z、W的聚集状态可能是
A. Z,W为气体,X,Y中之一为气体
B. Z,W中之一为气体,X,Y为非气体
C. X,Y,Z,W皆为气体
D. X,Y为气体,Z,W中之一为气体
( C )10. PH=7的盐酸和PH=9的氢氧化纳溶液以体积比11:9混合,混合液的pH
A. 为7.2 B. 为8 C. 为6 D. 无法计算
( B )11. 取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A. 醋酸与锌反应放出氢气多
B. 盐酸和醋酸分别与锌反应放出的氢气一样多
C. 醋酸与锌反应速率小
D. 盐酸和醋分别与锌反应的速度一样大
( D )12. 从下列现象可以判断某酸是强酸的是
A.加热该酸至沸腾也不分解 B.该酸可以分解石灰石放出CO2
C.该酸可以把Al(OH)3沉淀溶解 D.该酸浓度为0.1mol·L-1时的pH为1
( A )13. 将0.1mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液的pH增加 B. CH3COOH电离度变大
C. 溶液的导电能力减弱 D. 溶液中c(OH-)减少
( D )14. 用0.01mol/L NaOH溶液完全中和pH=3的下列溶液各100mL。需NaOH溶液体积最大的是
A. 盐酸 B. 硫酸 C. 高氯酸 D. 醋酸
( A)15. 用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤V2
二、填空题(每空3分,共30分):
16.在95℃时,纯水的pH 小于 (填“大于”“小于”“等于”)7,所选择的理由是:25℃时纯水的pH = 7,当升高温度时,水的电离程度增大,c(H+)也增大,故pH减小 。
17. 25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
⑴a值可否等于3(填“可”或“否”)否 ,其理由是:若a=3,则b=6,溶液显酸性,与题意不符,故a≠3 ;
⑵a值可否等于5(填“可”或“否”)否 ,其理由是:若a=5,c(H+)=10-5mol·L-1,则b=10,c(OH-) =10-4mol·L-1 ,Va/Vb=c(OH-)/c(H+) >1,不符合题意,故a≠5 ;
⑶、a的取值范围是:7/2<a<14/3 。
18.有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
⑴如果加入蒸馏水,就加入_900 __ mL ;
⑵如果加入pH = 10的NaOH溶液,应加入_1000___ mL ;
⑶如果加入0.008 mol/L HCl溶液,应加入_100____ mL。
三、推断题(每空4分,共32分):
19. 下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去。
—2—
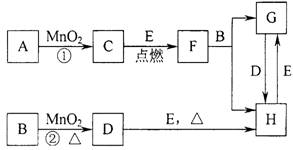 ⑴写出有关物质的名称或化学式:
⑴写出有关物质的名称或化学式:
B:HCl ,F:FeO ,H: FeCl 。
⑵指出MnO2在相关反应中的作用:反应①中是 催化 剂,反应②中是 氧化 剂.
⑶若反应①是在加热条件下进行,则A是 KClO ;若反应①是在常温条件下进行,A是HO 。
⑷写出B与MnO2共热获得D的化学方程式:MnO+4HCl(浓)MnCl+C1↑+2HO 。
四、选择题(每小题有一个或两正确答案):
( D )20.下列叙述正确的是
A pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B 溶液中[H+]越大,pH值也越大,溶液的酸性就越强
C 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
(CD)21.在25℃时,某稀溶液中由水电离产生的[H+]=10-13mol/L。下列有关该溶液的叙述正确的是
A. 该溶液一定呈酸性 B. 该溶液一定呈碱性
C. 该溶液的pH值可能为1 D. 该溶液的pH值可能为13
(BD)22. 下列溶液中,pH>8的是
A. 0.1mol/L氨水跟0.1mol/L盐酸等体积混合后的溶液
B. 将pH=12的NaOH溶液稀释至100倍后所得到的溶液
C. 将pH=5的醋酸溶液稀释至10000倍后所得到的溶液
D. c(OH-)=10-6mol/L的NaOH溶液10mL加入浓度10-5mol/L的NaOH溶液100mL后的溶液
(CD)23.浓度都是0.2mol/L的盐酸(甲)和醋酸溶液(乙)各50mL,分别加入等体积的0.1mol/L的烧碱溶液。以下关于反应后甲、乙两杯溶液的说明,错误的是
A. 甲溶液的pH在1~2之间 B. 甲溶液的pH较乙小
C. 甲溶液的pH较乙大 D. 乙溶液的pH仍然小于7
(BC)24.向一定体积的0.1摩/升的醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是
A.溶液的pH值变小 B.醋酸的电离度增大
C.溶液的导电能力减弱 D.中和此溶液所需的0.1摩/升NaOH溶液的体积增加
( D )25.下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B. [H+]=1×10-7mol·L-1 的溶液
C. pH=14-pOH 的溶液
( A )26. 下列说法中正确的是
A.在25℃纯水中,c(H+)=c(OH-)=10-7 mol/L,呈中性
B.溶液中,若c(H+) > 10-7 mol/L,则c(H+) > c(OH-),呈酸性
C.c(H+)越大,则pH越大,溶液的碱性越强
D.pH为0的溶液,其中只有H+而无OH-
( A )27. 下列四种溶液中,由水电离生成的氢离子浓度之比(①∶②∶③∶④)是:①1mol/L的盐酸;②0.1 mol·L-1的盐酸;③0.01 mol·L-1的NaOH溶液;④0.001mol/L的NaOH溶液
—3—
A.1:10:100:1000 B.0:1:12:11
C.14:13:12:11 D. 14:13:2:3
( C )28. 中和相同体积,相同pH的Ba(OH)2、NaOH、和NH3·H2O三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3则三者关系为
A.V3﹥V2﹥V1 B.V3 = V2﹥V1 C.V3﹥V2 = V1 D.V1 = V2﹥V3
(BC)29.恒温恒压下,在容积可变的密闭容器中发生反应:A(g) + B(g)![]() C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是
C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是
A.若开始通入3mol A和3mol B,达到平衡后将生成3a mol C
B.若开始通入x mol A、2mol B和1mol C,达到平衡后密闭容器中有1mol A和3mol C,则x为3
C.若开始时通入4 mol A、2 mol B和1 mol C,达到平衡时,B的物质的量一定大于2mol
D.若开始时通入2molA、2 mol B和1 mol C,达到平衡后,再通入3 mol则再次到达平衡后,C的物质的量分数为a/(2-a)
( C )30. 取等质量的单质A和化合物B两种固体,分别投入足量的水中,产生C、D两种气体。一定条件下,C和D恰好可完全反应,则下列叙述中正确的是
A. 1 molA和1 molB的质量相同 B. 1 molA和1 molB中所含的质子数相同
C. 1molA和1/2molB所含的电子数相同 D. 1/2molA和1molB中所含的中子数相同
(AB)31.在一定温度下,可逆反应N2+3H2![]() 2NH3达到平衡的标志是
2NH3达到平衡的标志是
A.1个N≡N键断裂的同时,有6个N—H键断裂 B.N2、H2、NH3的体积分数不再变化
C.N2、H2、NH3的物质的量浓度相等 D.N2、H2、NH3的分子数之比为1:3:2
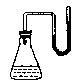 (A)32.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化①NaOH粉末;②18mol/L的H2SO4溶液;③NH4NO3晶体;④Na2O2固体;⑤生石灰
(A)32.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化①NaOH粉末;②18mol/L的H2SO4溶液;③NH4NO3晶体;④Na2O2固体;⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
五、填空题:
33. 今有a、盐酸;b、硫酸;c、醋酸三种酸:
⑴在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末, 在相同条件下产生CO2的体积由大到小的顺序是__c>a=b____。
⑵在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是__b>a=c____。
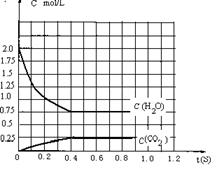 ⑶物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是__c>a>b__ ;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的 NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 b>a=c (填序号)。
⑶物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是__c>a>b__ ;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的 NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 b>a=c (填序号)。
![]()
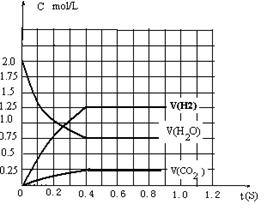
![]() 34.在完全满足可逆反应:2H2O(g) 2H2+O2,2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
34.在完全满足可逆反应:2H2O(g) 2H2+O2,2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
⑴请在图中画出c(H2) 随时间t的变化曲线图;
⑵平衡时 c (O2)平为 0.5mol /L mol/L。
⑶欲计算出平衡时O2的浓度,除已知“H2O(g)和CO”
—4—
的物质的量外,至少需要知道平衡体系中某两种气体的平衡浓度。这两种气体除可以是H2O和CO2外还可以是H和CO(或H和CO或HO和CO) 。
⑷在其它条件不变的情况下,若改为起始时在容器中充入2molH2和2molCO2,则上述两反应达到平衡时,c (O2)平= 0.5mol mol/L。
35.有H2SO4和HCl的混合溶液20mL,加入0.025mol·L-1Ba(OH)2溶液时,生成沉淀的质量W(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液pH=7),求:
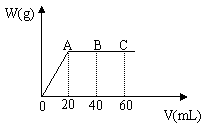 ⑴原混合液中H2SO4和HCl的物质的量浓度
⑴原混合液中H2SO4和HCl的物质的量浓度
⑵A点和B点时溶液的pH。
—5—
武汉市汉阳一中第一轮综合测试试卷(四) (答案)
一、选择题:
1.D 2.C 3.B 4.D 5.D 6.A 7.B 8.B 9.D 10.C 11.B 12.D 13.A 14.D 15.A
二、填空题:
16. 小于 ,25℃时纯水的pH = 7,当升高温度时,水的电离程度增大,c(H+)也增大,故pH减小。
17. ⑴否 ,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3 ;
⑵否 ,若a=5,c(H+)a=10-5mol·L-1,则b=10,c(OH-)b =10-4mol·L-1 ,Va/Vb=c(OH-)b/c(H+)a >1,不符合题意,故a≠5 ;
⑶7/2<a<14/3 。
18.⑴_900 __ mL ;⑵_1000___ mL ;⑶100_____ mL。
三、推断题:
19. ⑴B:HCl ,F:Fe3O4 ,H: FeCl3
⑵ 催化 , 氧化 。
⑶则A是 KClO3 ;A是H2O2
⑷MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O 。
MnCl2+C12↑+2H2O 。
四、选择题(每小题有一个或两正确答案):
20.D 21.CD 22.BD 23.CD 24.BC 25.D 26.A 27.A 28.C 29.BC 30.C 31.AB 32.A
五、填空题:
33. ⑴__c>a=b____。⑵_b>a=c__。⑶_c>a>b_;b>a=c 。
34.⑴请在图中画出c(H2) 随时间t的变化曲线图;
 ⑵ 0.5mol
/L。
⑵ 0.5mol
/L。
⑶H2和CO(或H2和CO2或H2O和CO) 。
⑷ 0.5 mol/L。
35、(1)A点:0.025×20×10-3=c(H2SO4)×20×10-3
c(H2SO4)=0.025mol·L-1(2分)
C点:0.025×60×10-3×2=[0.025×2+c(HCl)]×20×10-3
c(HCl)=0.1mol·L-1(2分)
(2)A点n(OH-)=0.025×2×20×10-3mol n(H+)=(0.025×2+0.1)×20×10-3mol
c(H+)=![]() pH=2-lg5=1.30(2分)
pH=2-lg5=1.30(2分)
B点![]()
pH=1.78(2分)
—6—
